
Ричард Роудс
Создание атомной бомбы
Хотя в этой работе, первой научной статье Бора, поверхностное натяжение определялось только для воды, она также исключительно расширила теорию Рэлея. Академия присудила ей золотую медаль. Работа эта была необычайным достижением для столь молодого автора, и именно она направила Бора в физику. В отличие от математизированной философии физика была прочно укоренена в реальном мире.
В 1909 году лондонское королевское общество приняло статью о поверхностном натяжении в несколько отредактированном виде для публикации в своем журнале Philosophical Transactions. Бору, по-прежнему бывшему на момент выхода статьи всего лишь студентом, еще не получившим даже магистерской степени, пришлось объяснять секретарю Королевского общества, письма которого были адресованы с использованием предполагаемого ученого звания, что он «не профессор»[285].
Однажды отъезд за город уже помог ему. Возможно, он мог помочь и еще раз. Уехать в Нерумгард больше было нельзя, так как семья Адлер отдала это имение под школу. Между мартом и маем 1909 года, когда Бору пришло время готовиться к экзаменам на магистерскую степень, он поехал в городок Виссенбьерг на острове Фюне, соседствующем на западе с Зеландией, островом, на котором находится Копенгаген, и поселился там в доме священника, принадлежавшем родителям лаборанта Кристиана Бора. Вместо работы Нильс читал на Фюне «Стадии жизненного пути». Дочитав эту книгу, он в тот же день с восторгом отправил ее Харальду. «Это единственное, что я считаю нужным послать, – писал он младшему брату, – и, по-моему, вряд ли можно найти что-либо лучшее. Во всяком случае, лично я получил от этой книги громадное удовольствие. Я даже думаю, что это одна из лучших книг, которые мне приходилось читать»[286][287]. В конце июня, вернувшись в Копенгаген, Бор сдал – опять-таки в последний день – свою дипломную работу, переписанную почерком его матери.
К тому времени Харальд вырвался вперед: он получил магистерскую степень в апреле, после чего уехал в аспирантуру в Университет имени Георга-Августа в немецком Гёттингене, центр европейской математики. В июне 1910 года он получил в Гёттингене докторскую степень. Нильс иронично писал младшему брату, что его «зависть скоро вырастет до неба»[288], но на самом деле он был доволен тем, как шла работа над его собственной диссертацией несмотря на то, что он потратил «четыре месяца на рассуждения по дурацкому вопросу о каких-то дурацких электронах и [смог] только написать штук четырнадцать более или менее противоречащих друг другу черновиков»[289]. Кристиансен дал Бору в качестве темы магистерской дипломной работы задачу из электронной теории металлов; эта тема настолько заинтересовала Бора, что он продолжил работу над нею и в своей диссертации. Теперь он специализировался в теоретической физике; как он объяснял, заниматься одновременно с этим и физикой экспериментальной было бы «непрактично»[290].
Осенью 1910 года он снова вернулся в пасторский дом в Виссенбьерге. Работа шла медленно. Возможно, он вспомнил, как трудно давалась диссертация лиценциату, потому что он снова обратился к Кьеркегору. «Он произвел на меня сильное впечатление, когда я писал свою диссертацию на Фюне, и я читал его работы сутками напролет, – рассказывал Бор в 1933 году своему другу и бывшему ученику Й. Руд Нильсену. – Особенно восхищала его честность, его готовность последовательно решать задачи до самого конца. Кроме того, у него великолепный, часто очень изящный язык. Разумеется, у Кьеркегора есть много такого, с чем я не могу согласиться. Я отношу это на счет того времени, в котором он жил. Но меня восхищают его энергичность и упорство, та последовательность, с которой он доводит свой анализ до самого конца, и то, что благодаря этим качествам он превратил несчастья и страдание в нечто хорошее»[291].
К концу января 1911 года он закончил свою диссертацию «Исследования в области электронной теории металлов». 3 февраля скоропостижно умер его отец, которому было пятьдесят шесть лет. Бор посвятил свою диссертацию «памяти моего отца, с глубочайшей благодарностью»[292]. Он очень любил отца; если раньше на нем лежало бремя ожиданий, то теперь он был свободен от этого бремени.
Как было принято, защита диссертации, состоявшаяся в Копенгагене 13 мая, была открытой для публики. «Д-р Бор, бледный и скромный молодой человек, – писала копенгагенская газета Dagbladet в заметке, над которой был помещен небрежный рисунок соискателя, стоящего во фрачном костюме за массивной кафедрой, – не принимал большого участия в обсуждении, которое заняло рекордно короткое время»[293]. Маленький зал был переполнен. Кристиансен, бывший одним из двух членов комиссии, сказал просто, что в Дании вряд ли найдется человек, обладающий достаточными знаниями по теме диссертации, чтобы оценить работу соискателя.
Перед смертью Кристиан Бор помог сыну получить стипендию Фонда Карлсберга, позволявшую ему продолжить обучение за границей. Лето Нильс провел в парусных и пеших прогулках с Маргрете Норланд, сестрой своего друга, красивой молодой студенткой, с которой он познакомился в 1910 году; незадолго до его отъезда они обручились. В конце сентября он уехал в Кембридж. Он должен был учиться в Кавендишской лаборатории под руководством Дж. Дж. Томсона.
29 сентября 1911 г.
Элтисли-авеню 10,
Ньюхэм, Кембридж
О Харальд!
У меня все прекрасно. Я только что разговаривал с Дж. Дж. Томсоном и рассказал ему, насколько смог, о своих идеях относительно радиации, магнетизма и т. д. Если бы ты только знал, что́ значил для меня разговор с таким человеком. Он был со мной чрезвычайно любезен, и мы обсудили очень многое; мне кажется, что он нашел в том, что я говорил, нечто разумное. Теперь он собирается прочитать [мою диссертацию] и пригласил меня на воскресный ужин в Тринити-колледж; потом он поговорит со мной о ней. Можешь себе представить, как я счастлив… У меня теперь есть собственная маленькая квартира. Она расположена на краю города и прекрасна во всех отношениях. У меня две комнаты, и я ем в полном одиночестве у себя дома. Здесь очень мило; сейчас я пишу тебе перед своим собственным маленьким камином, в котором пылает, потрескивая, огонь[294].
Нильс Бор был в восторге от Кембриджа. Благодаря англофилии отца ему легко было полюбить английскую жизнь; в университете же поддерживались традиции Ньютона и Максвелла и была великая Кавендишская лаборатория, славная столь многими физическими открытиями. Бор обнаружил, что его школьный английский далек от совершенства, и взялся за чтение «Дэвида Копперфильда», вооружившись внушительным новым словарем, в котором он смотрел все слова, в которых не был уверен. Он обнаружил, что в лаборатории было слишком много народу и слишком мало средств. С другой стороны, ему было забавно ходить в мантии и академической шапочке (после того, как его официально приняли в докторантуру Тринити-колледжа)«под страхом огромного штрафа», наблюдать профессорский стол колледжа, «за которым едят столько и таких первоклассных блюд, что совершенно невероятно и непонятно, как они с этим справляются»[295], гулять «по часу перед ужином по прекраснейшим лугам вдоль реки, с изгородями, усеянными красными ягодами, и одинокими ивами, клонящимися на ветру, – вообрази себе все это под великолепнейшим осенним небом со стремительно несущимися облаками и неистовым ветром»[296]. Он записался в футбольную команду; встречался с физиологами, учившимися у его отца; посещал лекции по физике; работал над экспериментами, которые поручал ему Томсон; общался на банкетах с английскими дамами, «абсолютно гениально умеющими вызывать на откровенность»[297].
Однако Томсон так и не собрался прочитать его диссертацию. Собственно говоря, их первая встреча была вовсе не столь успешной. Новый датский ученик не просто рассказал Томсону о своих идеях; он еще и указал ему на ошибки, которые он обнаружил в работах самого Томсона по теории электрона. «Интересно, – писал Бор Маргрете вскоре после этого, – что скажет профессор по поводу моих замечаний к его статье»[298]. Немного спустя он писал: «Не могу дождаться момента, когда Томсон наконец выскажется. Он – великий человек. Надеюсь, мои глупые вопросы не рассердили его»[299][300].
Мы не знаем, рассердился Томсон или нет. В это время электроны уже не очень его интересовали. Он переключил свое внимание на положительно заряженные анодные лучи – эксперимент, в котором он предложил участвовать Бору, касался именно их, и Бор считал его совершенно бесперспективным, – и в любом случае не любил теоретических обсуждений. «Чтобы по-настоящему узнать англичанина, требуется полгода, – сказал Бор в своем последнем интервью. – В Англии принято быть вежливым и так далее, но на самом деле они никем не интересуются… По воскресеньям я ходил на ужины в Тринити-колледж… Я сидел там, и в течение многих воскресений со мной никто ни разу не заговорил. Но потом они увидели, что я так же не стремлюсь разговаривать с ними, как и они со мной. И тогда мы подружились, понимаете, и все изменилось»[301]. Тут речь идет об общем представлении; возможно, безразличие Томсона было его первым частным проявлением.
А потом в Кембридже появился Резерфорд.
Он «приехал из Манчестера, чтобы выступить на ежегодном Кавендишском обеде, – вспоминает Бор. – Хотя в этот раз мне не удалось познакомиться с Резерфордом, на меня произвели глубокое впечатление его обаяние и энергия – качества, с помощью которых ему удавалось достигать почти невероятных вещей, где бы он ни работал. Обед происходил в чрезвычайно непринужденной атмосфере, что дало удобный случай коллегам Резерфорда напомнить некоторые из многочисленных анекдотов, уже тогда связанных с его именем»[302][303]. Резерфорд тепло говорил о недавней работе физика Ч. Т. Р. Вильсона, изобретателя туманной камеры (в которой можно наблюдать траектории заряженных частиц, проявляющиеся в виде линий водяных капель в перенасыщенном паре), с которым он дружил во время учебы в Кембридже. Как говорит Бор, Вильсон «только что» сфотографировал в своей камере альфа-частицы, рассеивающиеся в результате взаимодействия с ядрами, – то самое явление, которое всего за несколько месяцев до этого «привело [Резерфорда] к открытию, с которого началась новая эпоха, – открытию атомного ядра»[304][305].
Бора уже занимали вопросы, которые он вскоре после этого связал с задачей о ядре и теоретически неустойчивых электронах[306], но самое большое впечатление на этом ежегодном обеде произвело на него то, насколько Резерфорд был готов отбросить церемонность. Вспоминая этот период своей жизни много лет спустя, он особенно выделял среди достоинств Резерфорда следующее: «…у него все же хватало терпения выслушивать каждого из этих молодых людей, если он ощущал у них наличие каких-то идей, какими бы скромными с его собственной точки зрения они ни казались»[307][308]. В отличие, надо думать, от Дж. Дж. Томсона, каковы бы ни были другие достоинства последнего.
Вскоре после этого обеда Бор приехал в Манчестер, чтобы встретиться там с «одним из коллег моего недавно умершего отца, бывшим также близким другом Резерфорда»[309]. Это близкий друг свел их. Резерфорд посмотрел на молодого датчанина, и он ему понравился, несмотря на его обычную нелюбовь к теоретикам. Впоследствии кто-то спросил его об этом противоречии. «Бор не такой, – прогремел Резерфорд, пытаясь замаскировать шуткой свою привязанность. – Он же футболист!»[310] Бор отличался от прочих и в другом отношении; он был гораздо талантливее всех остальных многочисленных учеников Резерфорда – а Резерфорд воспитал за свою жизнь целых одиннадцать нобелевских лауреатов[311], и этот его рекорд не побил никто.
Бор отложил решение о выборе между Кембриджем и Манчестером до обсуждения всей этой ситуации с Харальдом, который специально для этого приехал к нему в Кембридж в январе 1912 года. Затем Бор отправил Резерфорду пылкую просьбу предоставить ему возможность учиться в Манчестере, о которой они говорили в декабре. Резерфорд посоветовал ему не бросать Кембридж слишком быстро – Манчестер, сказал он, никуда от него не денется[312], – и Бор предложил приехать к началу весеннего семестра, который начинался в конце марта. Резерфорд согласился с радостью. Бору казалось, что в Кембридже его способности тратятся впустую. Он хотел заняться чем-то существенным.
Первые шесть недель в Манчестере он провел, изучая «вводный курс в экспериментальные исследования радиоактивности»[313]; среди его наставников были Гейгер и Марсден. Продолжал он и свои собственные исследования теории электрона. В это время началась его сохранившаяся на всю жизнь дружба с молодым венгерским аристократом Дьёрдем де Хевеши, радиохимиком, человеком с вытянутым, чувственным лицом, самой заметной чертой которого был огромный нос. Отец де Хевеши был придворным советником, мать – баронессой; в детстве он охотился на куропаток в собственном охотничьем заказнике императора Австро-Венгрии Франца-Иосифа, граничащем с имением его деда. Теперь же он работал над решением задачи, которую поставил ему однажды Резерфорд: ему нужно было отделить продукты радиоактивного распада от веществ, породивших их. На основе этой работы в течение нескольких последующих десятилетий он развил науку применения радиоактивных индикаторов в медицинских и биологических исследованиях, ставшую очередным примером ценных всходов, которые дали небрежные, но плодовитые посевы Резерфорда.
От де Хевеши Бор и узнал о радиохимии[314]. Он начал находить в ней связи со своей работой по электронной теории. Посетившее его затем интуитивное озарение было поразительным. В течение нескольких недель он понял, что, хотя радиоактивные свойства порождаются атомным ядром, свойства химические зависят в первую очередь от числа и распределения электронов. Он понял – и эта безумная идея оказалась справедливой, – что, поскольку электроны определяют химические свойства, а суммарный положительный заряд ядра определяет число электронов, то положение элемента в периодической системе в точности совпадает с величиной заряда ядра (или «атомным номером»): водород стоит на первом месте и имеет заряд ядра, равный 1, за ним следует гелий с зарядом ядра, равным 2, и так далее, вплоть до самого урана с номером 92.
Де Хевеши обратил его внимание на то, что число известных радиоактивных элементов уже значительно превосходило число незаполненных клеток периодической таблицы, и Бор интуитивно пришел еще к одному заключению. Содди уже отмечал, что радиоактивные элементы в большинстве своем представляют собой не новые элементы, а лишь физически отличные формы элементов природных (вскоре после этого он дал им их современное имя, назвав их изотопами). Бор понял, что такие радиоэлементы должны иметь тот же атомный номер, что и природные элементы с теми же химическими свойствами. Это позволило ему вывести черновую версию так называемого закона радиоактивных смещений: при превращении элемента в результате радиоактивного распада он смещается по периодической таблице на два положения влево, если испускает альфа-частицу (ядро гелия, атома с номером 2), и на одно положение вправо, если испускает бета-излучение (высокоэнергетический электрон, потеря которого приводит к увеличению положительного заряда ядра).
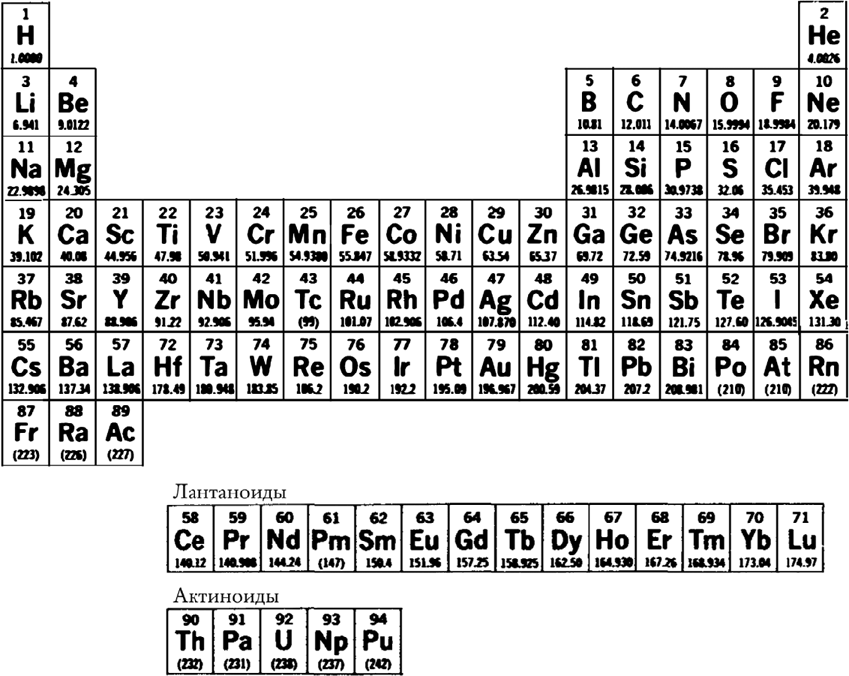
Периодическая система химических элементов. Семейство лантаноидов, начинающееся с лантана (57), и семейство актиноидов, начинающееся с актиния (89) и включающее в себя торий (90) и уран (92), обладают сходными химическими свойствами
Прочная привязка этих начальных, приблизительных озарений к теории эксперименту потребовала бы многих лет работы других ученых. Бор представил их Резерфорду. К его удивлению, первооткрыватель атомного ядра отнесся к его собственным открытиям настороженно. «Резерфорд… считал, что [накопленная до тех пор] скудная информация об атомных ядрах не настолько точна, чтобы можно было делать подобные выводы, – вспоминал Бор. – А я сказал ему, что уверен, что это станет окончательным доказательством справедливости его модели атома»[315]. Если он и не убедил Резерфорда, то по меньшей мере произвел на него сильное впечатление. Однажды, когда де Хевеши задал Резерфорду какой-то вопрос о радиоактивности, тот радостно ответил: «Спросите Бора!»[316] Таким образом, когда Бор снова пришел к нему в середине июня, Резерфорд был готов к неожиданностям. Бор описал, что было у него на уме, в письме, которое он послал Харальду 19 июня, после этого разговора:
Мне кажется, что я, возможно, открыл кое-что относительно строения атомов. Об этом ни в коем случае нельзя никому рассказывать, иначе я точно не смог бы так быстро написать тебе про это. Если я прав, эта идея должна оказаться не указанием на одну из возможностей… а, может быть, маленьким элементом реальности… Как ты понимаешь, еще может выясниться, что я не прав, потому что идея еще не до конца разработана (хотя я так не думаю); кроме того, Резерфорд, по-моему, тоже не считает ее совершенно безумной. Он такой человек, который никогда не скажет, что он полностью убежден в чем-то, что еще не вполне проработано. Можешь себе представить, как мне хочется поскорее завершить эту работу[317].
Тогда Бор увидел первый проблеск идеи о том, как можно стабилизировать электроны, вращающиеся вокруг Резерфордова ядра в таком неустойчивом состоянии. Резерфорд отослал его прорабатывать эту идею более подробно. Время поджимало: на 1 августа в Копенгагене была назначена свадьба Бора с Маргрете Норланд. 17 июля он написал Харальду, что «дело движется довольно хорошо; по-моему, я кое-что обнаружил; но доведение этих находок до ума, несомненно, займет гораздо больше времени, чем мне по наивности казалось вначале. Я надеюсь подготовить перед отъездом небольшую статью, которую можно будет показать Резерфорду, так что я очень-очень занят; невероятная жара, которая стоит в Манчестере, не очень-то располагает меня к усердию. Как мне не терпится поговорить с тобой!»[318] В следующую среду, 22 июля, он встретился с Резерфордом, который снова подбодрил его, и планировал встретиться с Харальдом по дороге домой[319].
Бор женился, и его безмятежный брак с этой сильной, умной и красивой женщиной продлился всю жизнь. В течение осеннего семестра он преподавал в Копенгагенском университете. Новая модель атома, над разработкой которой он бился, давалась по-прежнему трудно. 4 ноября он написал Резерфорду, что надеется, что «сможет закончить статью в течение нескольких недель»[320]. Несколько недель прошло; поскольку статья так и не была закончена, он договорился об освобождении от преподавательской работы в университете и уехал вместе с Маргрете за город. Старая система снова сработала: он написал «очень длинную статью обо всем этом»[321]. Затем ему в голову пришла новая важная идея, и он разбил свою длинную статью на три заново переписанные части. Первая часть статьи под гордым и отважным названием «О строении атомов и молекул» была отправлена Резерфорду 6 марта 1913 года, вторая и третья части были закончены и опубликованы до конца того же года, – и эта работа изменила направление развития физики XX века. Именно за нее Бор получил Нобелевскую премию по физике за 1922 год.
Еще когда Бор работал над своей диссертацией, он решил, что некоторые из явлений, которые он исследовал, нельзя объяснить механическими законами ньютоновской физики. «Следует предположить, что в природе существуют силы, совершенно отличные от обычных механических»[322], – писал он в то время. Он знал, где именно следует искать эти необычные силы: он обратился к работам Макса Планка и Альберта Эйнштейна.
Планк был тем немецким теоретиком, с которым Лео Сцилард впоследствии познакомится в Берлине в 1921 году; он родился в 1858 году и преподавал в Берлине с 1889-го. В 1900 году он предложил революционную идею, которая объясняла одну неразрешимую до того момента проблему классической физики, так называемую ультрафиолетовую катастрофу. В соответствии с классической теорией внутри нагретой полости (например, доменной печи) должно содержаться бесконечное количество света (энергии, излучения). Это связано с тем, что классическая теория, рассматривающая только непрерывные процессы, предсказывает, что частицы, заключенные внутри нагретых стенок полости, вибрирующих с выделением света, должны вибрировать в бесконечном спектре частот.
Очевидно, это предсказание не соответствовало истине. Но что же мешает энергии, содержащейся внутри полости, неограниченно увеличиваться в направлении глубокой ультрафиолетовой части спектра? Планк начал работать над этой задачей в 1897 году и интенсивно трудился над нею в течение трех лет. Успех пришел к нему в виде возникшего в последнюю минуту озарения, о котором он сообщил 19 октября 1900 года на заседании Берлинского физического общества. Тем же вечером друзья Планка сравнили его новую формулу с экспериментально полученными данными. На следующее утро они сообщили ему об их точном соответствии. «Более поздние измерения все снова и снова подтверждали формулу для излучения, и притом тем точнее, чем к более тонким методам измерений переходили, – гордо писал Планк в 1947 году, в конце своей долгой жизни»[323][324].
Планк разрешил проблему излучения, предположив, что колеблющиеся частицы могут излучать лишь на некоторых определенных энергиях. Разрешенные энергии определяются новым числом – «…необходимо было ввести некоторую новую универсальную постоянную, которую я обозначил через h, и так как она имела размерность произведения (энергия × время), то я назвал ее элементарным квантом действия»[325][326]. Слово «квант» происходит от формы среднего рода (quantum) латинского слова quantus, означающего «сколько». Могут возникать только такие ограниченные и конечные энергии, которые равны целочисленному кратному hν: частоты ν, умноженной на постоянную Планка h раз. По расчетам Планка, величина h оказалась очень малой и близкой к современному значению, равному 6,63 · 10–27 эрг · с. Универсальная константа h вскоре получила свое современное название: ее стали называть постоянной Планка.
Планку, который был консерватором до мозга костей, не хотелось исследовать радикальные следствия из найденной им формулы излучения. Это сделал другой человек – Альберт Эйнштейн. В опубликованной в 1905 году статье, которая впоследствии принесла ему Нобелевскую премию, Эйнштейн применил идею Планка строго определенных дискретных порций энергии к проблеме фотоэлектрического эффекта. Свет, падающий на некоторые металлы, выбивает из них электроны; подобный эффект используется в современных солнечных батареях, питающих космические аппараты. Но энергия электронов, выбитых из металла, не зависит от яркости света, как казалось бы логичным предположить. Вместо этого она зависит от его цвета – то есть от его частоты.
Эйнштейн разглядел в этом странном факте квантовые проявления. Он предложил еретическую гипотезу о том, что свет, распространяющийся, как показывали в течение многих лет точные научные опыты, в виде волн, на самом деле распространяется в виде маленьких отдельных пакетов – частиц, – которые он назвал «квантами энергии». Такие фотоны (как мы их теперь называем), писал он, имеют дискретную энергию hν и при соударении с поверхностью металла передают бо́льшую часть этой энергии электронам. Таким образом, более яркий свет высвобождает большее число электронов, но не электроны более высокой энергии; энергия испускаемых электронов зависит от hν, то есть от частоты света. Таким образом, Эйнштейн развил квантовую идею Планка, превратив ее из простого, хотя и удобного, вычислительного приема в выражение возможного физического закона[327].
Такое развитие знания позволило Бору взяться за проблему механической неустойчивости модели атома Резерфорда. В июле, в период подготовки «небольшой статьи, которую можно будет показать Резерфорду», у него уже появилась основная идея. Она заключалась в следующем: поскольку классическая механика предсказывает, что атом, по Резерфорду, с маленьким, массивным центральным ядром, окруженным электронами, должен быть неустойчивым, а на самом деле атомы представляют собой одни из самых устойчивых систем в мире, значит, классическая механика не способна описывать такие системы и должна уступить место квантовому подходу. Планк предложил квантовые принципы, чтобы спасти законы термодинамики; Эйнштейн распространил квантовые идеи на свет; Бор предлагал теперь ввести квантовые принципы в самый атом.
В течение всей осени и начала зимы, вернувшись в Данию, Бор разбирался со следствиями из этой идеи. Трудность с атомом Резерфорда заключалась в том, что ничто в его строении не обеспечивало его устойчивости. Если речь шла об атоме с несколькими электронами, он должен был разваливаться на части. Даже в случае атома водорода всего с одним (механически устойчивым) электроном классическая теория предсказывала, что такой электрон должен испускать свет при изменении направления орбитального движения вокруг ядра и, теряя таким образом энергию, смещаться по спиральной траектории к ядру и в конце концов упасть на него. С точки зрения ньютоновской механики атом Резерфорда – миниатюрная солнечная система – должен был быть либо невозможно большим, либо невозможно маленьким.
Поэтому Бор предположил, что в атоме должно существовать то, что он назвал «стационарными состояниями»: орбиты, на которых электроны могут находиться без нарушений устойчивости, без испускания света и без падения на ядро по спиральной траектории. Он произвел расчеты по этой модели и обнаружил, что их результаты отлично согласуются с самыми разными экспериментальными значениями. Теперь у него была по меньшей мере правдоподобная модель, которая, в частности, объясняла некоторые химические явления. Но она явно была произвольной; не было никаких доказательств того, что она более точно отражает реальное строение атома, чем другие полезные модели – например «пудинг с изюмом» Дж. Дж. Томсона.
Помощь пришла с неожиданной стороны. Дж. У. Николсон, профессор математики в Королевском колледже Лондона, которого Бор считал глупцом, опубликовал несколько статей, в которых для объяснения необычного спектра солнечной короны предлагалась квантованная сатурнианская модель атома. Статьи эти были опубликованы в астрономическом журнале в июне; Бор увидел их только в декабре. Он быстро нашел недостатки модели Николсона, но в то же время почувствовал, что другие исследователи идут за ним по пятам, – а также отметил, что Николсон углубился в дебри спектральных линий.
Ориентируясь на химию, обмениваясь идеями с Дьёрдем де Хевеши, Бор не думал о том, что доказательства в поддержку его модели атома можно искать и в спектроскопии. «Спектры были очень сложной задачей, – сказал он в своем последнем интервью. – …Они казались великолепными, но в них не было видно возможностей для развития. Точно так же, если взять крыло бабочки, на нем, конечно, можно увидеть замечательно регулярные узоры, цвета и так далее, но никому не придет в голову, что по окраске крыла бабочки можно понять основы биологии»[328].
Воспользовавшись подсказкой Николсона, Бор обратил теперь свое внимание на крылья спектральной бабочки.
В 1912 году спектроскопия была хорошо развитой областью. Первым эффективно исследовал ее шотландский физик XVIII века Томас Мелвилл. Он смешивал химические соли со спиртом, поджигал эти смеси и рассматривал полученный свет через призму. Разные химические элементы давали пятна разных цветов. Отсюда возникла идея использования спектров для химического анализа, для идентификации неизвестных веществ. Призматический спектроскоп, изобретенный в 1859 году, был важным научным достижением. В нем использовалась узкая щель, установленная перед призмой, чтобы превратить световые пятна в узкие полоски сравнимой ширины; эти полоски можно было отобразить на линейке с делениями (а впоследствии – на ленте фотопленки), чтобы измерить расстояния между ними и вычислить длины волн света. Такие характеристические наборы линий стали называть линейчатыми спектрами. У каждого элемента имеется свой уникальный линейчатый спектр. Гелий был открыт в виде серии необычных линий в хромосфере Солнца в 1868 году, за двадцать три года до того, как его обнаружили в составе урановой руды на Земле. Линейчатые спектры оказались предметом полезным.
Однако никто не понимал, что́ порождает эти линии. В лучшем случае математикам и спектроскопистам, любившим заниматься численным выражением длин волн, удавалось найти в наборах спектральных линий красивые и гармоничные закономерности. В 1885 году швейцарский математик и физик XIX века Иоганн Бальмер нашел одну из самых основных формул – формулу для вычисления длин волн спектральных линий водорода. Эти линии, образующие так называемую серию Бальмера, выглядят следующим образом:
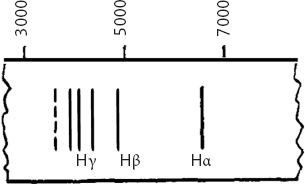
Серия Бальмера
Не обязательно разбираться в математике, чтобы оценить простоту выведенной Бальмером формулы, которая предсказывает положение любой линии в спектре с точностью до одной тысячной. В этой формуле содержится всего одно произвольное число:
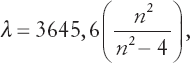
где греческая буква λ (лямбда) обозначает длину волны линии, а n принимает для разных линий значения 3, 4, 5 и так далее. При помощи этой формулы Бальмер смог предсказать ожидаемые длины волн линий еще не изученных участков спектра водорода. Впоследствии такие линии были найдены именно там, где они должны были быть по его расчетам.
Шведский спектроскопист Йоханнес Ридберг превзошел достижение Бальмера, опубликовав в 1890 году общую формулу, справедливую для огромного числа разных линейчатых спектров. Формула Бальмера стала частным случаем более общей формулы Ридберга, в основе которой лежало число, названное постоянной Ридберга. Это число, впоследствии измеренное различными способами и ставшее одной из наиболее точно известных фундаментальных постоянных, по современным измерениям равно 10973731,568508 м–1 [329].
Эти формулы и числа могли быть известны Бору из университетского курса физики, особенно с учетом того, что Кристиансен был поклонником Ридберга и досконально изучил его работы. Но спектроскопия была далека от области интересов Бора, и можно предположить, что он о них просто забыл. Он нашел своего старого друга и одноклассника Ханса Хансена, физика и спектроскописта, который только что вернулся из Гёттингена. Вместе с Хансеном они просмотрели материалы по регулярности линейных спектров. Бор нашел соответствующие числа. «Как только я увидел формулу Бальмера, – говорил он впоследствии, – мне всё немедленно стало ясно»[330].



