
Юрий Степанович Почанин
Водородное топливо. Производство, хранение, использование
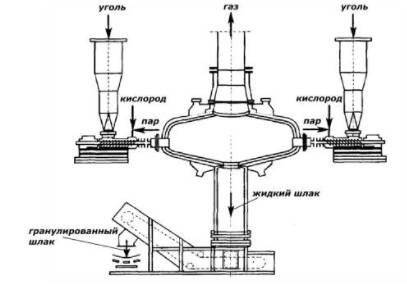
Рис.2.11. Схема газификатора Копперса-Тотцека
Соотношение потоков на 0,05–0,5 кг пара. При этом подача пара организована таким образом, чтобы он «обволакивал» пылеугольный факел снаружи, тем самым предохраняя футеровку от зашлаковывания, эрозии, а также действия высоких температур. В реакционной камере достигается высокая степень превращения органической части угля с образованием смеси газов. Состав сырого газа изменяется в следующих пределах (% об.): СО -55–66, Н2- 21–32, С02- 7–12, N2- около 1, H2S – 0,5–1, СН4- 0,1. Теплота сгорания газа составляет 10–12 МДж/м3. При использовании низко реакционного топлива (например, кокса) содержание СО2 повышается, а Н2 снижается, при высоко реакционном топливе, наблюдается противоположный эффект. Полученный газ вначале проходит котел-утилизатор, вырабатывающий пар высокого давления, затем осуществляется его очистка. После обработки в скрубберах Вентури содержание пыли составляет около 5–15 мг/м3. В случае необходимости оно может быть снижено до 0,25 мг/м3 при пропускании газа через электрофильтр. Затем газ охлаждается и подвергается обессериванию традиционными методами.
Температуры газификации составляет обычно 1500–1700°С, в следствии чего достигается высокая степень конверсии углерода, при этом почти все органические вещества угля превращаются в газообразные продукты, в которых практически отсутствуют пиролизные смолы. Это существенно упрощает очистку продукт-газа. Еще одним достоинством данного метода является возможность переработки практически любых топлив независимо от их спекаемости.
Различные конструкции реакторов данного типа позволяют проводить процесс во вращающемся или вихревом потоке, в потоке, направленном вверх или вниз, а также с переменным направлением. При любом варианте топливо сначала реагирует с кислородом, при этом достигается максимальная температура, а затем накопленный потенциал тепла расходуется в эндотермических реакциях газификации.
Для получения водорода процесс Копперса-Тотцека достаточно эффективен. Одним из недостатков процесса является необходимость в использовании дорогостоящих мельниц для тонкого размола топлива, а также повышенный расход кислорода по сравнению с другими методами газификации. Главной проблемой при эксплуатации данных газогенераторов является необходимость в обеспечении бесперебойной подачи пылевидного топлива, так как из-за малого времени его пребывания в реакционной зоне незначительные перерывы в питании могут привести к появлению свободного кислорода в камере и других частях, что может привести к взрывоопасной ситуации. Необходимо подчеркнуть, что именно этот способ сейчас наиболее распространен в мире.
2.2.3. Процесс Винклера
Газогенераторы Винклера, коммерциализованные в 1926 году, являются первым промышленным применением технологии газификации в кипящем слое. Газогенераторы Винклера работают при давлении близком к атмосферному, в режиме кипящего псевдоожиженного слоя. Уголь измельчают до размеров менее 8 мм. Как показано на рис.2.12 уголь поступает в бункер, а затем шнековым питателем подается в объем газогенератора, где создается кипящий слой.
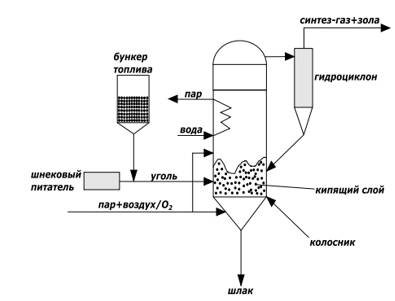
Рис.2.12. Схема газогенераторов Винклера
Поскольку слой находится практически при атмосферном давлении, могут использоваться относительно простые системы подачи угля. Подаваемый в газогенератор газифицирующий агент, состоящий из пара, а также воздуха или кислорода, разбит на два потока. Газ, подаваемый через колосник, ожижает слой и реагирует с ним. Частицы угля в результате горения уменьшаются в размере и становятся более легкими. Примерно 30% золы проваливаются сквозь колосник и образуют «донную» золу. Оставшиеся 70% золы улавливаются гидроциклоном и возвращаются в газогенератор, увеличивая тем самым тепловую емкость и инерцию слоя, а также для повторной конверсии остатков углерода в ней.
К преимуществу технологий кипящего слоя можно отнести возможность введения дополнительных реагентов, помимо угля и инертного материала. В частности, введение в кипящий слой соединений кальция (обычно известняк или доломит) позволяет связывать серу, находящуюся в угле. Преимуществом этих газогенераторов является возможность использования более широких фракций угля, включая мелочь, которая выносится из слоя и газифицируется в надслойном пространстве. Основной же проблемой данных газогенераторов является то, что унесенная зола содержит значительное количество непрореагировавшего углерода. Температура кипящего слоя составляет примерно 1000–1100°С, что чуть ниже температуры размягчения золы. Для максимализации конверсии углерода рабочая температура слоя находится близко к этой лимитирующей температуре. Тепло отводится через верхнюю часть газификатора. Газогенераторы Винклера ранее широко использовались, но недолго, в настоящее время практически нигде не используются из-за низкой степени конверсии углерода.
В 1970–80гг. был разработан высокотемпературный газогенератор Винклера. Главным отличием от оригинальной конструкции явилась возможность работы под давлением (примерно 1 МПа). Увеличение давления позволило повысить степень конверсии углерода. Работа под давлением повлекла изменения в системе подачи угля, рис. 2.13.
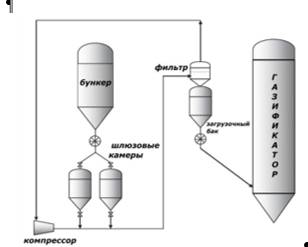
Рис.2.13. Схема высокотемпературного генератора Винклера
Уголь при атмосферном давлении загружается в бункер. Далее в одной из двух шлюзовых камер сбрасывается давление и в нее поступает уголь из бункера. Затем входной клапан закрывается и в камеру нагнетается давление, после чего открывается нижний клапан и уголь проваливается на линию, где пневматически транспортируется на фильтр.
Газ после фильтра повторно идет в компрессор, а уголь поступает в загрузочный бак. Питание газогенератора происходит за счет дозирующего клапана, расположенного на дне загрузочного бака. Использование двух шлюзовых камер позволяет данным газогенераторам работать в непрерывном режиме.
Процесс имеет существенные достоинства:
–возможность непрерывной подачи топлива в газогенератор;
–интенсивную теплопередачу и хорошее перемешивание, обеспечивающее изотермический режим в реакционной зоне;
–простоту регулирования температуры и высокую производительность аппарата
Наиболее предпочтительными топливами для газификации по этому методу являются бурые и реакционноспособные каменные угли, буроугольный кокс или полукокс. Усовершенствование процесса Винклера возможно путем повышения температуры и давления процесса.
У процесса есть следующие недостатки:
–большой унос с газом непрореагировавшего топлива, которое трудно возвратить на газификацию,
–пониженные температуры в зоне реакции, лимитируемые выводом золы в сухом виде;
–невозможность переработки спекающихся каменных углей из-за слипания их частиц нарушается режим работы газогенератора;
–сложная система загрузки топлива.
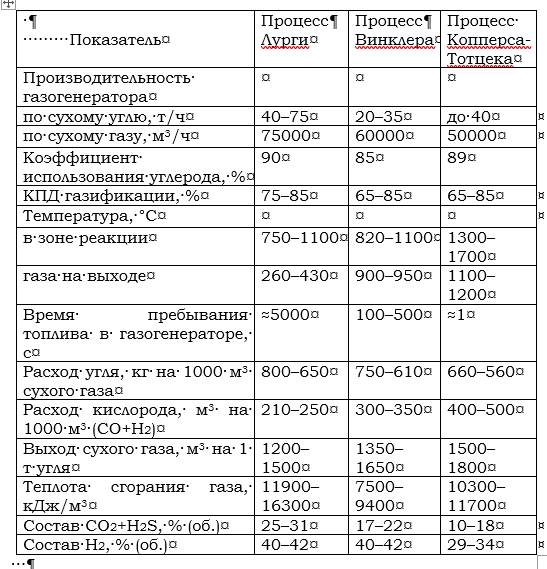
Для сравнения процессов, рассмотренных выше в таблице 2.5, приведены основные их показатели.
Таблица 2.5. Основные показатели процессов газификации твердых топлив
Наряду с рассмотренными выше методами газификации угля, которые можно сейчас уже назвать классическими, начиная с середины прошлого столетия в разных странах интенсивно разрабатываются более прогрессивные методы. В ряде случаев они представляют собой усовершенствованные варианты рассмотренных процессов.
2.2.4. Железо-паровой процесс
Одним из процессов, основанном на использовании многоступенчатой газификации является железо-паровой процесс производства водорода. Процесс основан на том, что активные металлы вытесняют водород из воды, например, натрий и кальций разлагают воду при обычных условиях, магний – при нагревании, цинк – при накаливании с водяным паром, железо – при нагревании около 700°С. На первой ступени газификации используемый кокс газифицируется с помощью паровоздушного дутья, в результате чего получается газ, содержащий СО, Н2 и N2. Наличие азота не является недостатком, так как промежуточные процессы позволяют от него избавиться. Полученный газ используется для восстановления окисла железа Fe3O4 до FeO в соответствии с реакциями:
Fe3O4 + СО = 3FeO + СО2;
Fe3O4 + Н2 = 3FeO + Н2О.
Образовавшиеся в результате этих реакций СО2, Н2О и N2 после утилизации теплоты выбрасываются в атмосферу. Если исходное дутье имеет повышенное давление, то наиболее целесообразно использовать эти газы в газотурбинной установке. При этом КПД процесса получения водорода достигает 63%, из которых 18% приходится на вырабатываемую электроэнергию.
На следующей стадии полученная окись железа FeO направляется в окислитель, где при более низкой температуре одна из двух прежних реакций происходит в обратном направлении:
3FeO + Н2О = Fe3O4 + Н2
При обычных для этого процесса температурах равновесие реакции таково, что ее продукты содержат около 37% водорода (остальное – в основном водяной пар, который удаляется конденсацией).
Железо-паровой процесс обладает рядом существенных недостатков сравнительно с конверсионным: он требует большего расхода водяного газа и дает водород со значительным содержанием примесей.
2.2.5. Процесс СО2-акцептор
Все рассмотренные выше методы газификации основываются на автотермическом проведении реакции. Поэтому газифицирующая газовая смесь содержит водяной пар и кислород (или воздух), соотношение которых определяет конечную температуру процесса газификации. При этом для получения газа с более высокой теплотой сгорания и для уменьшения затрат на очистку от азота предпочитают использовать не паровоздушное, а парокислородное дутье. Это существенно удорожает процесс за счет включения в него установки для разделения воздуха. Однако, есть и другая возможность получить недостающую теплоту для эндотермической реакции угля с водяным паром. Среди схем с аллотермическим подводом теплоты, реализующих эту возможность, представляют интерес схемы, в которых недостающая теплота образуется за счет побочной химической реакции с участием дополнительно вводимого в зону реакции реагента. В качестве примера такого способа следует упомянуть метод СО2-акцептор, разработанный в США. Здесь теплота вводится в зону газификации за счет реакции СаО с двуокисью углерода с образованием доломита:
СаО + СО2 = СаСО3.
При этой реакции выделяется около 176,8 кДж/моль. Этого количества теплоты достаточно, чтобы осуществить газификацию угля только водяным паром. Схема газификации по методу СО2-акцептор представлена на рис. 2.14. Процесс газификации происходит в кипящем слое при давлении 1–2 МПа. Отсортированный и высушенный уголь подается через шлюз вначале в камеру термического разложения, где при температуре 800–850°C происходит пиролиз исходного угля продуктами газификации. Поэтому получающийся газ содержит продукты пиролиза, хотя при указанной температуре в среде водяного пара они частично разлагаются. Часть образовавшегося полукокса поступает в собственно кипящий слой газификатора. В верхнюю часть слоя поступает регенерированный доломит с температурой около 1025°C.
В нижнюю часть слоя подается паровое дутье. Образующаяся в результате реакции с водяным паром двуокись углерода вступает в реакцию с СаО, образуя доломит и поставляя теплоту для эндотермической реакции угля с водяным паром. Более крупные и тяжелые частицы СаСО3 постепенно опускаются в нижнюю часть слоя. Непрореагировавший уголь и зола уносятся газами вверх, а СаСО3 выводится из газификатора и направляется на регенерацию.
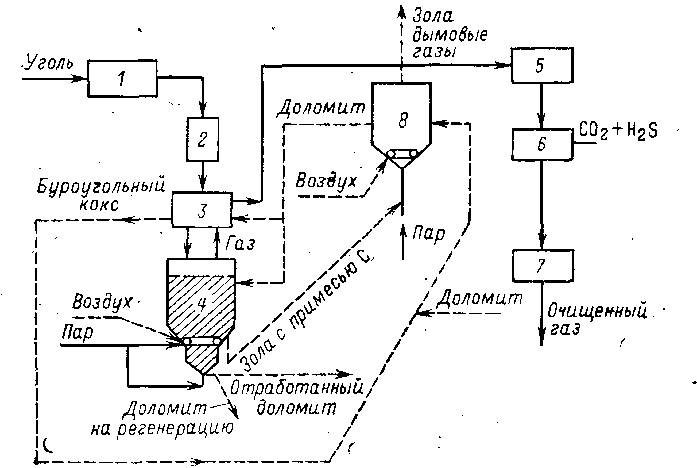
Рис.2.14. Схема газификации по методу СО2-акцептор:
1-зона подготовки угля, 2-загрузочный шлюз, 3-зона термического разложения, 4-газификатор с кипящим слоем, 5-система котел-утилизатор + водяной скрубер, 6-аппарат для очистки газа, 7-реактор метанирования, 8-регенератор с кипящим слоем
Регенерация представляет собой эндотермический процесс, происходящий при температуре около 1025°C:
СаСО3 = СаО + СО2.
В регенераторе также организуется кипящий слой. Здесь теплоту для реакции регенерации поставляет сжигание в воздухе части полукокса, выводимого из камеры термического разложения. Регенерированный доломит возвращается в газификатор, а дымовые газы из регенератора вместе с золой направляются на утилизацию теплоты, в частности на производство водяного пара в котле-утилизаторе.
Недостатком процесса СО2-акцептор является сравнительно низкая температура газификации, лимитируемая термической стойкостью доломита (~850°C). Из-за этого в газе, как уже отмечалось, остаются продукты пиролиза и требуются специальная очистка как газов, так и воды. Газ, получаемый по этому методу, содержит (по объему): 16% СО, 11% СО2, 56% Н2, 15% СН4 (прочие компоненты- около 2 %). Таким образом, содержание водорода достаточно велико, но велико и содержание метана, связанное с высоким давлением.
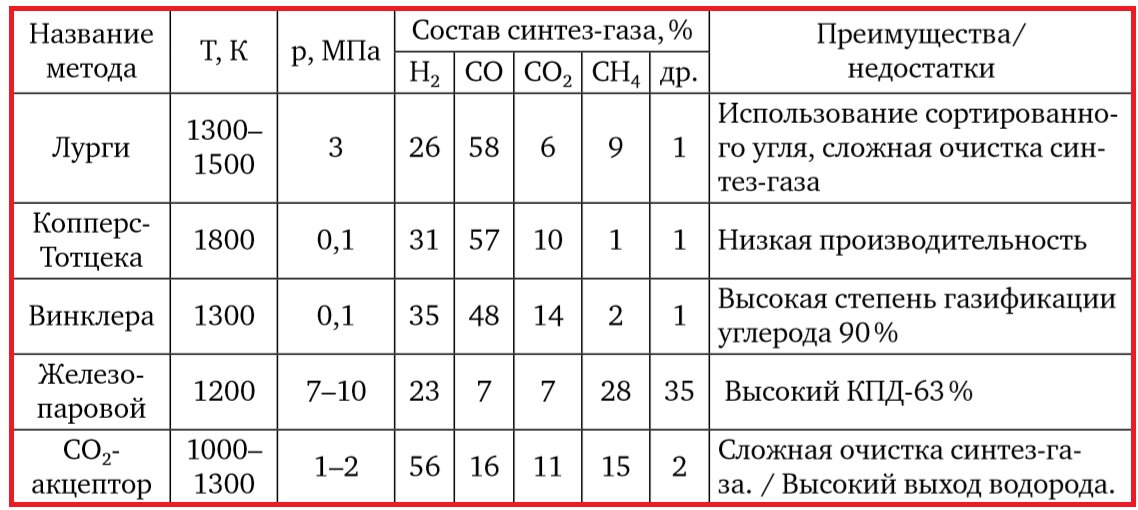
Сравнительный состав синтез-газа, полученный различными методами показан в таблице 2.6.
Таблица 2.6. Сравнительный состав синтез-газа
Таким образом, в конечном итоге теплоту для эндотермической реакции газификации угля водяным паром поставляет горение того же угля, но так как продукты сгорания не смешиваются с продуктами газификации, может быть использовано дешевое воздушное дутье.
Для выделения водорода из синтез-газа используются разнообразные методы: адсорбция, абсорбция, диффузии через мембраны, электрохимическая конверсия, глубокое охлаждение, катализ.
2.3. Плазменная газификация угля
Находит применение плазменная парокислородная газификация угля, который относится к классу процессов с внутренним подводом тепла. Данный метод позволяет удерживать постоянную температуру процесса порядка 1500–2000°C во всем объеме газогенератора. Высокая рабочая температура обеспечивает получение синтез-газа, который не содержит окислителей таких, как СО2 и Н2О.
Процесс заключается в том, что измельченный уголь в смеси с кислородом перемешивается плазменной струей водяного пара в плазмотроне, а затем попадают в газогенератор, где при температурах 1500°C и выше получают синтез-газ с достаточно высоким содержанием водорода и оксида углерода и незначительным содержанием СО2, Н2О и N2. КПД такого газогенератора достигает 80–90%.
В плазменных газификаторах также используются плазменные фурмы для газификации твердого топлива. Этот тип газификаторов зачастую используют для уничтожения сложно-газифицируемых бытовых и коммунальных отходов, а также отходов медицинской деятельности. Главная отличительная особенность плазменной технологии газификации заключается в значительной интенсификации процесса деструкции отходов, который протекает за весьма короткий промежуток времени за счет передачи энергии обрабатываемым материалам излучением и конвекцией. На рис. 2.15 представлена схема плазменного газификатора.
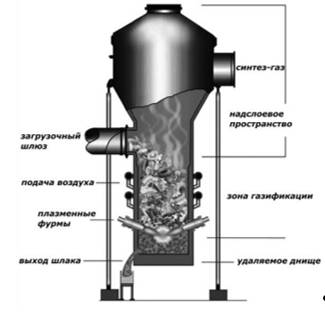
Рис. 2.15. Плазменный газификатор
Твердое топливо загружается с боковой стороны газификатора, плазменные фурмы расположены по направлению движущегося слоя. Вблизи фурм температура может достигать значений 3000°С. Расплавленный метал и шлак выгружаются из нижней части реактора. Организация выгрузки шлака является привлекательной для переработки твердых коммунальных отходов, т.к. токсичные металлы в шлаке практически не извлекаемы. Газ поднимается в верхнюю часть газификатора и попадает в расширенную надслоевую зону, которая позволяет крупным твердым частичкам снова попасть в слой. Газ покидает газификатор при температуре 900–1000°С, что достаточно для деструкции пиролизных смол.
Теплота сгорания синтез-газа составляет примерно 80% от теплоты сгорания исходного топлива. Синтез газ может быть использован для генерации электроэнергии. Электричество для работы плазменных фурм составляет от 2 до 5% энергии поступающего сырья.
Существует множество технологий с различными конструкциями газогенераторов, но все они являются «синтезом» основных и не имеют столь широкого применения. Это основные, хорошо освоенные и изученные методы промышленного получения водорода. Однако все они дороги в сравнении с традиционной энергетикой.
Производство синтез-газа, в состав которого входят: водород, метан, окислы углерода и прочие газы – может быть также основано на переработке биомассы и промышленно-бытовых отходов, что одновременно способствует решению экологических проблем. Например, переработать отходы жизнедеятельности рогатого скота, да и вообще любого другого сельскохозяйственного животного.
При термохимической обработке биомассы её нагревают без доступа кислорода до температуры 500–800°C, в результате чего образуются водород, метан и оксид углерода.
2.4. Термохимические циклы получения водорода
Термохимические циклы объединяют исключительно источники тепла (термо) с химическими реакциями для разделения воды на водород и кислород. Термин «цикл» используется потому, что, помимо воды, водорода и кислорода, химические соединения, используемые в этих процессах, непрерывно рециркулируются. Если электричество частично используется в качестве входа, результирующий термохимический цикл определяется как гибридный.
Более высокая температура увеличивает скорость реакции и уменьшает количество этапов, необходимых для процесса.
Тепловая энергия вводится в термохимический цикл через одну или более эндотермических высокотемпературных химических реакций. Для отвода энергии на выходе цикла используется одна или более экзотермических низкотемпературных реакций. Все реагенты, кроме воды, восстанавливаются и вновь поступают в цикл. Таким образом, термохимические и комбинированные циклы по получению водорода – это многостадийное разложение воды с помощью различных химических реакций. В сущности, термохимические циклы – это связывание воды, отщепление водорода и кислорода, регенерация реагентов:
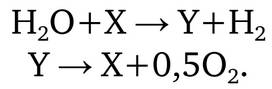
Реагенты X и Y, а в многостадийных способах используются и дополнительные вещества, определяют название циклов: галоидные, на основе металлов и их оксидов, на основе различных соединений углерода и циклы на основе серы.
В термохимических и комбинированных циклах с точки зрения экономики и экологии наиболее конкурентно способны циклы, в которых используются дешевые и легкодоступные реагенты: оксиды железа, серы, углерода, хлориды железа.
По массообмену методы делятся на замкнутые и разомкнутые, у первых в ходе реакций расходуется только вода, тепло и электроэнергия (если цикл комбинированный), у вторых, кроме перечисленных, расходуются реагенты (X, Y и др.), которые, из экономической целесообразности, являются промышленными отходами: сероводород, сернистый ангидрид, различные сульфиды, не полностью окислившиеся металлы.
Все современные промышленные методы получения водорода являются разомкнутыми термохимическими циклами. Их характерная особенность заключается в том, что энергию, необходимую для разложения воды на водород и кислород, получают путем сжигания органического горючего; процесс получения водорода из воды сопровождается реакцией связывания кислорода углеродом горючего с образованием диоксида углерода.
Рассмотрим несколько циклов, используемых для получения водорода.
1. Цикл «йод – сера» (IS) трехступенчатый термохимический цикл, используемый для производства водорода и состоит из трех химических реакций, чистым реагентом которых является вода, а чистыми продуктами –водород и кислород. Схема цикла IS представлен на рис 2.16. Все остальные химические вещества могут повторно использоваться в цикле.
Три реакции, которые производят водород, следующие:
1. I2+ SO2+ 2H2O + нагрев до 120°C → 2HI+ H2SO4 –Реакция Бунзена. Затем HI отделяют дистилляцией или гравитационным разделением.
2. H2SO4+ нагрев до 830°C →SO2+H2O+1/2O2.
Воду, SO2 и остаточную H2SO4 необходимо отделить от кислорода путем конденсации.
3. 2HI + нагрев до 450°C → I2+H2.
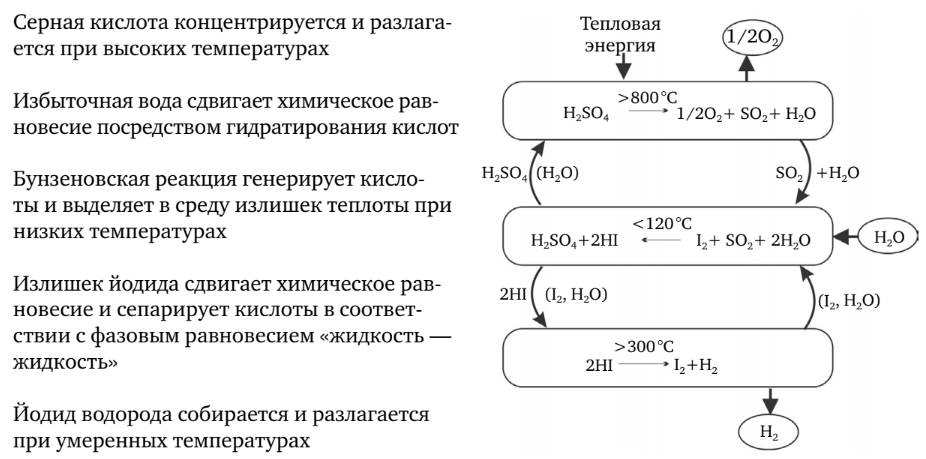
Рис. 2.16. Схема термохимического цикла «йод – сера»
Йод и любая сопутствующая вода или SO2 отделяются путем конденсации, а водород остается в виде газа.
Чистая реакция: 2H2O → 2H2+ O2
Серная кислота разлагается при температуре до 830°C, высвобождая кислород и возвращая в оборот диоксид серы. Йодид водорода разлагается при температуре от 350 до 450°C, высвобождая водород и возвращая в оборот йод. Конечный результат реакции – разложение воды на водород и кислород. На входе процесса требуются только вода и высокотемпературная тепловая энергия, а на выходе образуются водород, кислород и низкотемпературная тепловая энергия.
Соединения серы и йода восстанавливаются и повторно используются, поэтому процесс рассматривается как цикл. Этот процесс IS представляет собой химический тепловой двигатель. Тепло входит в цикл в высокотемпературных эндотермических химических реакциях 2 и 3, а выходит из цикла в низкотемпературной экзотермической реакции 1.
Преимущества цикла:
–все вещества (жидкости, газы) повторно используются, поэтому хорошо подходят для непрерывной работы;
–высокий коэффициент использования тепла (около 50%);
–подходит для использования с солнечными, ядерными и гибридными источниками тепла;
–технически более отработанный процесс, чем конкурирующие термохимические процессы.
Недостатки:
–требуются очень высокие температуры (минимум 850°C);
–коррозионные реагенты, используемые в качестве посредников (йод, диоксид серы, иодоводородная кислота, серная кислота); следовательно, для изготовления технологического оборудования необходимы коррозионностойкие материалы.
Испытательные установки лабораторного масштаба для цикла IS с низким давлением успешно демонстрировались в Японском институте атомной энергии. Подготовку к лабораторным испытаниям при прототипных условиях по давлению и температуре в настоящее время совместно проводят GA, SNL и CEA-Saclay, рис.2.17.
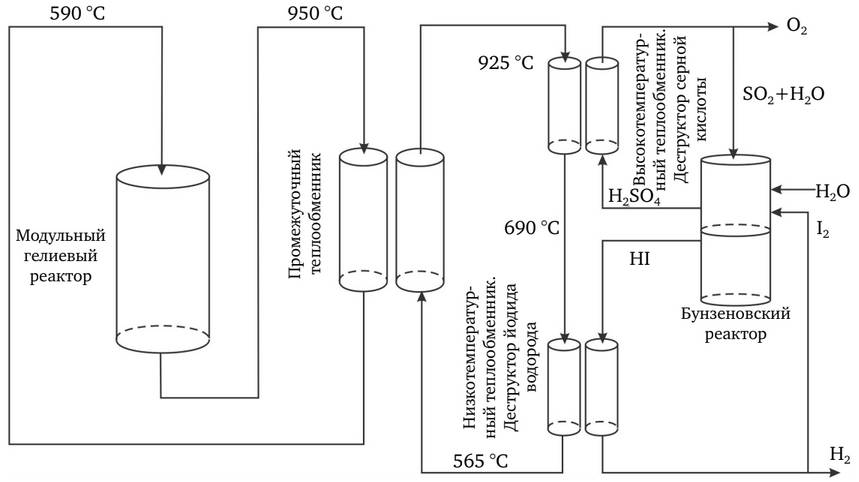
Рис.2.17. Схема термохимического процесса разделения воды «йод – сера»
Цикл IS требует высоких температур, но предлагает высокую эффективность преобразования тепловой энергии в водород). Главное преимущество состоит в том, что масштаб химических реакций определяется объемом, а не площадью электродов, как это имеет место при электролизе.
Цикл может выполняться с любым источником очень высоких температур, примерно 950°C, например, с помощью концентрации солнечной энергии (система CSP) и считается хорошо подходящим для производства водорода высокотемпературными ядерными реакторами.
Таким образом, крупномасштабное производство водорода в ядерной энергетике должно обеспечить существенную экономию. Детальное изучение проекта указывает, что цикл IS, соединенный с модульным гелиевым реактором, мог бы производить водород по стоимости 1,50–2,00 долл./кг, что почти сравнимо со стоимостью производства водорода из природного газа.
2. Цикл «медь – хлор» (Cu–Cl) является четырехступенчатым термохимическим циклом для производства водорода. Представляет собой гибридный процесс, в котором используются этапы термохимии и электролиза. Его максимальная температура составляет около 530°C.
Цикл Cu – Cl включает четыре химические реакции:
1.2. Cu + 2HCl (г)→ 2 CuCl (ж)+ Н2 (г) (430–475°С)
2.2. CuCl2+H2O (г) → Cu2OCl2 + 2 HCl (г) (400°C)
3.2. Cu2OCl2→ 4CuCl+ O2 (г) (500°C)
4. 2. CuCl → CuCl2 (водн.) + Cu (электролиз при температуре окружающей среды)
Чистая реакция: 2H2O → 2H2+ O2
Преимуществами цикла медь-хлор являются более низкие рабочие температуры, возможность использования низкопотенциального отходящего тепла для повышения энергоэффективности и потенциально более дешевые материалы. По сравнению с другими термохимическими циклами, процесс Cu–Cl требует относительно низких температур до 500°C.
Еще одним важным достоинством этого цикла является относительно низкое напряжение (следовательно, низкий расход электроэнергии), необходимое для электрохимической стадии (от 0,6 до 1,0 В). Общий КПД цикла Cu – Cl составляет чуть более 43%, исключая дополнительные потенциальные выгоды от использования отходящего тепла в цикле.
Недостатком цикла является то, что работа с твердыми частицами в процессе, где есть агрессивные рабочие жидкости, представляет собой проблему для разработки инженерного оборудования.
Процесс Cu–Cl может быть связан с ядерными установками или другими источниками тепла, такими как солнечная энергия и промышленные отходы тепла, чтобы потенциально достичь более высокого КПД, меньшего воздействия на окружающую среду и более низких затрат на производство водорода по сравнению с любой другой традиционной технологией.
Процесс Cu–Cl – один из важнейших термохимических циклов, разрабатываемых Международным форумом «Поколение IV». Целью форума, куда входят более десятка стран по всему миру, является разработка ядерных реакторов следующего поколения для высокоэффективного производства как электроэнергии, так и водорода.
3. Гибридный цикл серы, также известный как HyS-цикл, является двухступенчатым процессом разделения воды, используемый в производстве водорода. Цикл основан на окислении и восстановлении серы и классифицируется как гибридный термохимический цикл, потому что на одной из двух стадий использует электрохимическую (вместо термохимической) реакцию. Оставшийся термохимический этап используется совместно с серо-йодным циклом.
Две реакции в цикле HyS следующие:
1. H2SO4 (водн.) → H2O (г) + SO2 (г) + ½ O2 (г) (термохимический, T> 800°C)
2. SO2 (водн.) + 2H2O (ж)→H2SO4 (водн.) + H2 (г) (электрохимический T= 80–120°C)
Чистая реакция: H2O (ж)→ H2 (г)+ ½ O2 (г)
Схема гибридного серного цикла представлен на рис. 2.18.
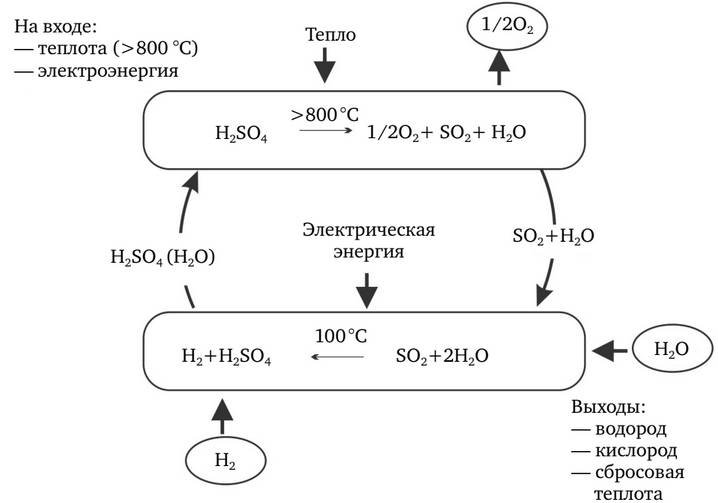
Рис. 2.18. Гибридный серный цикл
Недавняя работа Национальной лаборатории Savannah River (SRNL) привела к усовершенствованию процесса в HyS-цикле. Был проведен анализ технологической схемы HyS-системы, объединенной с охлаждаемым гелием ядерным реактором. Расчетная чистая тепловая эффективность установки составила 48,8% при температуре на входе в процесс, равной 900°C. Разработка деполяризованного SО2-электролизёра, соответствующего заданным рабочим параметрам, имеющего долгий срок эксплуатации и эффективного по затратам, является основной целью продолжающихся исследований. Разработка дешевого электролизёра – ключевой фактор в получении эффективного по затратам HyS-цикла.
Предварительный экономический анализ, показывает, что HyS-цикл в комбинации с охлаждаемым гелием газовым реактором мог бы производить водород при затратах ~1,60 долл./кг, что примерно соответствует затратам процесса IS. Дополнительные доходы от продажи побочного продукта (кислорода), могут уменьшить издержки.
Технические проблемы включают оптимизацию эксплуатационных режимов (температура, давление, кислотная концентрация), материалы для строительства, проект ячейки (в том числе, выбор мембраны и нагрузки электрокатализатора), а также долговечность и рабочие характеристики.
Глава 3. Промышленные способы очистки водорода
В чистом водороде нуждаются химическая и нефтехимическая промышленность (производство мономеров), энергетика (создание автономных стационарных и мобильных источников энергии для питания топливных элементов), восстановительная металлургия (отжиг сталей специального назначения, легирование порошков, получение прецизионных сплавов), полупроводниковая, микро и наноэлектронная, пищевая, медицинская отрасли (производство особо чистых материалов, веществ и изделий).
При производстве водорода, получают продуктовый водородный газ, который включает побочные продукты: углекислый газ, угарный газ, метан, вода, аргон, азот и кислород. В остаточных газовых потоках от химических или нефтехимических процессов присутствуют различные примеси: углеводороды, метанол, сероводород и аммиак. Все эти примеси должны быть удалены прежде, чем он будет использован в технологии. Соответственно, очистка водорода от различных примесей становится главным этапом на пути получения высококачественного продукта,
Всеми существующими и перспективными промышленными способами производится либо водород технической чистоты (95–99,8 об. %), либо газовые смеси, содержащие от 30 до 95 об. % водорода. В любом случае необходима дополнительная очистка чистого водорода.
В промышленности реализованы несколько способов очистки водорода из углеродосодержащего сырья (т.н. водородсодержащий газ – ВСГ). Основные из них: короткоцикловая адсорбция (КЦА), очистка полимерными мембранами, криогенный способ и очистка неорганическими мембранами (Рd сплавами).
3.1. Способ короткоцикловой адсорбции
В технологии короткоцикловой адсорбции применяется принцип физического связывания примесей, содержащихся в обогащенных водородом газах, с помощью индивидуально подобранных адсорбирующих материалов. Поскольку силы связывания для таких примесей зависят от давления, КЦА работает в чередующемся цикле адсорбции при высоких давлениях и десорбции при низких давлениях. Для достижения непрерывного потока продукта водорода по меньшей мере один адсорбер работает, а остальные находятся на разных стадиях регенерации.
Работа блока КЦА стала широко популярной в химической и нефтеперерабатывающей промышленности благодаря своей универсальности и способности адаптироваться к конкретным применениям. Например, отходящий газ нефтепереработки может быть очищен в системе КЦА, что позволяет нефтеперерабатывающим заводам извлекать чистый водород из потоков, содержащих легкие углеводороды.
Основным преимуществом КЦА является его способность адсорбировать такие соединения, как сероводород, углеводороды, оксиды углерода и воду.
КЦА работает по принципу, согласно которому при повышенном парциальном давлении адсорбенты могут удерживать больший объем газообразных компонентов, некоторые из которых сильнее, чем другие. Сила адсорбции обычно увеличивается с молекулярной массой каждого компонента, и водород обладает самой слабой силой адсорбции этих компонентов. Это позволяет адсорбировать более тяжелые компоненты, в то время как очищенный водород проходит через адсорбент.
В качестве сырья для установок КЦА выступает водородсодержащий газ с концентрацией водорода порядка 75–80%об. Продуктами являются водород с концентрацией выше 99,5%об., а также отдувочный газ с содержанием водорода 10–40% об.
Адсорбенты для систем КЦА обычно являются очень пористыми материалами, выбранными из-за их большой удельной поверхности. Типичными адсорбентами являются: активированный уголь, силикагель, оксид алюминия, полимеры, цеолиты.
Наибольшее значение для очистки водорода имеет адсорбция на цеолитах, размер пор которых соизмерим с размерами молекул. Через поры проходят, не задерживаясь, только молекулы, имеющие размер меньше размера пор цеолита; более крупные молекулы остаются на их поверхности. Водород по сравнению с другими газами имеет наименьший размер молекул и на цеолитах не задерживается. На поглощение вещества цеолитом еще большее влияние, чем размер, может иметь форма молекулы, ненасыщенный характер молекул.







