
Юрий Степанович Почанин
Водородное топливо. Производство, хранение, использование
Разнообразие источников получения водорода является одним из главных преимуществ водородной энергетики, так как повышает энергетическую безопасность и снижает зависимость от отдельных видов сырья.
Методы получения водорода подразделяются на физические, электрохимические и химические.
К физическим методам относятся те процессы, в которых исходное сырье (газовая смесь) уже содержит свободный водород и требуется тем или иным физическим путем освободить его от остальных компонентов.
В электрохимических методах выделение водорода из его химических соединений осуществляется разложением последних под действием электрического тока.
Химические методы являются наиболее распространенными способами получения водорода в целом и, в особенности для нефтеперерабатывающей и нефтехимической промышленности.
В настоящее время существует некоторые способы промышленного производства водорода:
–паровая конверсия метана и природного газа;
–пиролиз;
Также в редких случаях используется реакция алюминия и щелочного раствора.
Паровая конверсия метана и электролиз – это базовые технологии, вокруг которых, по мнению большинства исследователей, будет развиваться сектор производства водорода. Среди других способов можно выделить риформинг плазмы; риформинг на основе ионных мембран; конверсию метана с усилением сорбентом; микроканальные реакторы; разложение (пиролиз) метана с выделением углерода в твердом виде; высокотемпературные газоохлаждаемые ядерные реакторы и т.д. Эти технологии пока находятся на еще более ранних стадиях коммерциализации.
2.1. Паровая конверсия природного газа
В настоящее время крупнотоннажное производство водорода и водородосодержащих продуктов осуществляется в мире в основном путем паровой конверсии метана, являющегося основным компонентом природного газа и содержащего 25% водорода.
Паровая конверсия метана (ПКМ) – получение чистого водорода из лёгких углеводородов (например, метана, пропан-бутановой фракции) путём парового риформинга (каталитической конверсии углеводородов в присутствии водяного пара). Реформирование газового пара является самым популярным и самым дешевым способом производства водорода.
Метан–основной компонент природного газа, его концентрация в нём достигает от 77 до 99%. Высокое содержание метана и в попутных нефтяных газах – от 31 до 91%. Метан представляет собой фактически большую молекулу водорода, которая состоит из одного атома углерода и 4-х атомов водорода. Чтобы отделить водород от углеродной основы в метане, требуются пар и тепловая энергия при температурах 750–850°С, что и происходит в химических паровых риформерах на каталитических поверхностях. Процесс заключается в нагревании газа в присутствии водяного пара, никелевого катализатора и при давлении 2 МПа (около 19 атмосфер). Результирующая эндотермическая реакция расщепляет молекулы метана и образует оксид углерода CO и водород H2. Затем газообразный оксид углерода можно пропустить с паром через оксид железа или других оксидов и подвергаются реакция конверсии водяного газа для получения дополнительных количеств H2. Обратной стороной этого процесса является то, что его основными побочными продуктами являются CO, CO2 и другие парниковые газы. При одной тонне произведенного водорода также будет производиться от 9 до 12 тонн CO2, парниковый газ, который может улавливаться.
Конверсия парового природного газа обычно происходит в два этапа. Первый этап осуществляется в трубах, заполненных никелевым катализатором, нанесенным на алюминиевую подложку, рис. 2.3.
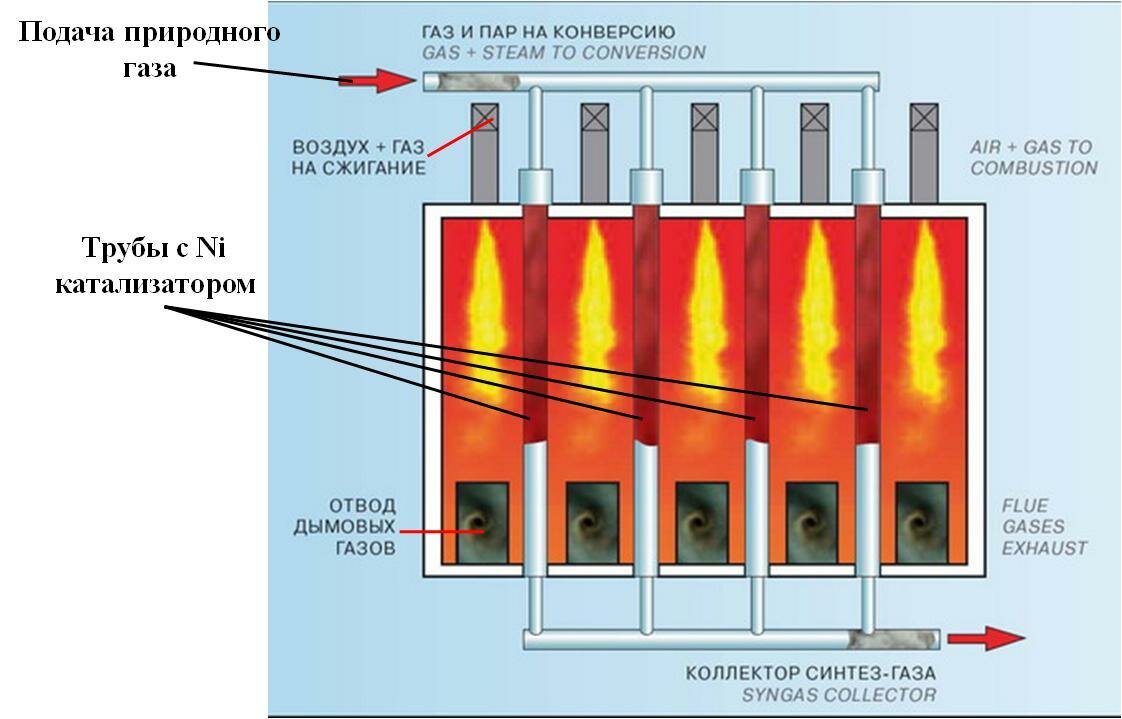
Рис.2.3. Схема реактора паровой конверсии природного газа
На этом этапе расщепляется метан и водяной пар на водород и монооксид углерода (синтез-газ):
СН4+ Н2О ↔ СО + 3Н2–206 кДж/моль.
На втором этапе выход водорода увеличивается благодаря дополнительной реакции СО с водой при пониженных температурах в присутствии катализаторов
«Реакция сдвига» превращает монооксид углерода и воду в диоксид углерода и водород:
СО + Н2О ↔ СО2+ Н2+ 44 кДж/моль.
Эта реакция происходит при температурах 200–250°С. При осуществлении указанных реакций может быть извлечено около 96% водорода, а необходимая теплота процесса получается при сжигании части природного газа. Тепло, необходимое для процесса, подается через стенки труб, нагретых снаружи путем сжигания другой части природного газа.
Очистка продуктового водорода производится в блоке короткоцикловой адсорбции (КЦА).
В парокислородной конверсии вместе с горячим паром в активную зону реактора подаётся кислород. Реакции процесса аналогичные, однако, дополнительно происходит окисление метана кислородом:
CH4+O2 ↔ 2CO+3H2.
Реагирование веществ в парокислородной конверсии метана даёт общий результирующий тепловой эффект, равный нулю. Это делает установку дороже на 5–10 %.
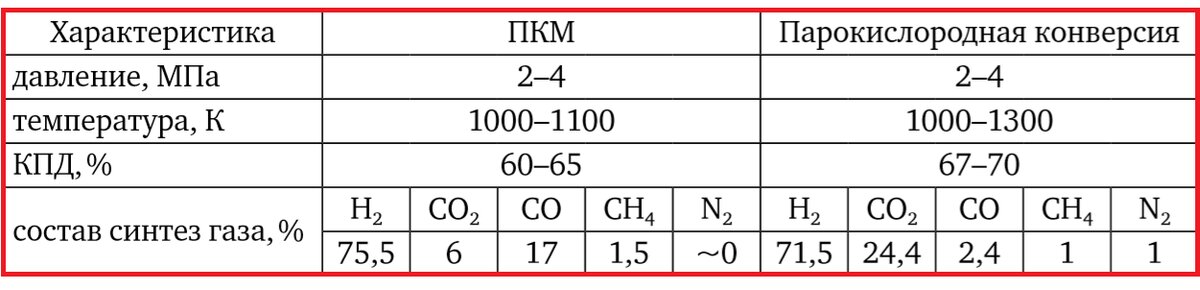
Главное преимущество парокислородной конверсии по сравнению с ПКМ – передача теплоты напрямую, а не через стенку теплообменника. Сравнение характеристик ПКМ и парокислородной конверсии представлено в таблице 2.1.
Таблица 2.1. Сравнение характеристик ПКМ и парокислородной конверсии
В настоящий момент уже разработан высокоэффективный проточный мембранный аппарат для одновременного риформинга метана и окисления СО на никелевых и палладиевых катализаторах. Чистота водорода достигает 99,999 %, тогда как при конверсии природного газа – всего 76,2%.
Наиболее критическими параметрами в этом способе производства водорода являются выбор оптимальной температуры процесса и выбор материала катализатора, т. е. его состава, а также стабильность работы такого катализатора. Для этих целей используются следующие типы катализаторов.
1.Разложение метана в присутствии массивного металлического катализатора (Fe, Co, Ni) при Т = 650–720°С.
2. Разложение углеводородных газов на поверхности железосодержащего катализатора при Т = 850–900°С под давлением 1–35 атм.
3.Разложение метана или других углеводородов на поверхности брикетированной сажи с никелем или сажи с железом при температурах ниже точки разложения этих соединений.
4.Разложение метана на поверхности катализаторов Ni/Al2O3 или Ni/Mg при Т =500–550°С.
5.Разложение метана на поверхности катализаторов Ni-Cu/Al2O3 или Ni-Cu/Mg при Т = 560–650°С.
Схема процесса конверсии метана следующая, рис.2.4.
Процесс конверсии метана состоит из следующих стадий.
1. Природный газ с содержанием CH4–97% поступает в сатуратор (1), где нагревается до 80°C и насыщается водяным паром, затем поступает в теплообменник (2).
2. В теплообменнике (2) газ нагревается до 500°C отходящими конверторными газами, смешивается с кислородом или воздухом и подаётся в конвертор (3).
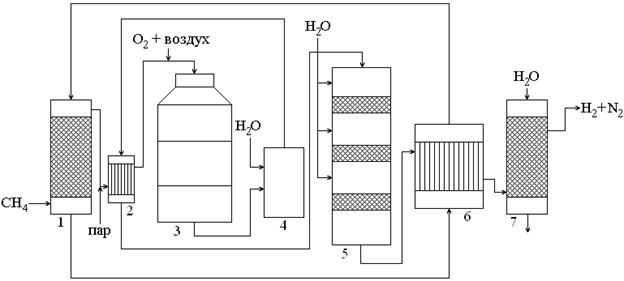
Рис.2.4. Схема процесса конверсии метана
3. В конверторе (3) сначала идут экзотермические реакции:
CH4+ ½O2 CO + 2H2+ Q
CO + 2H2+ Q
CH4+ 2O2 CO2+ 2H2O + Q
CO2+ 2H2O + Q
и температура повышается до 1000°C. Затем протекают эндотермические реакции:
CH4+ H2O CO + 3H2 – Q
CO + 3H2 – Q
CH4+ CO2 2CO + 2H2 – Q
2CO + 2H2 – Q
Конвертированный газ содержит H2–51–54%, N2(если подавали воздух) – 20%, CO – 20%, CO2–7%, CH4–0,5%.
4. Затем газ увлажняется в увлажнителе (4), охлаждается до 400–500°C в теплообменнике (2) и поступает в конвертор CO (5).
5. В конверторе CO (5) газ проходит ряд тарелок с катализатором, охлаждаясь между ними конденсатом.
6. Далее проходит через теплообменник (6).
7. И в промывной башне (7) очищается от твёрдой части и от CO, CO2, O2 методом последовательной конденсации.
В итоге получается либо чистый водород в случае использования для конверсии метана чистого кислорода, либо азото-водородная смесь, если используют в качестве окислителя воздух.
Технология получения водорода обычно включает очистку сырья от серосодержащих соединений, каталитическую конверсию углеводорода (УВ) с водяным паром и 4-хстадийную очистку конвертированного газа от оксидов углерода. Такую схему можно назвать классической, рис.2.5.
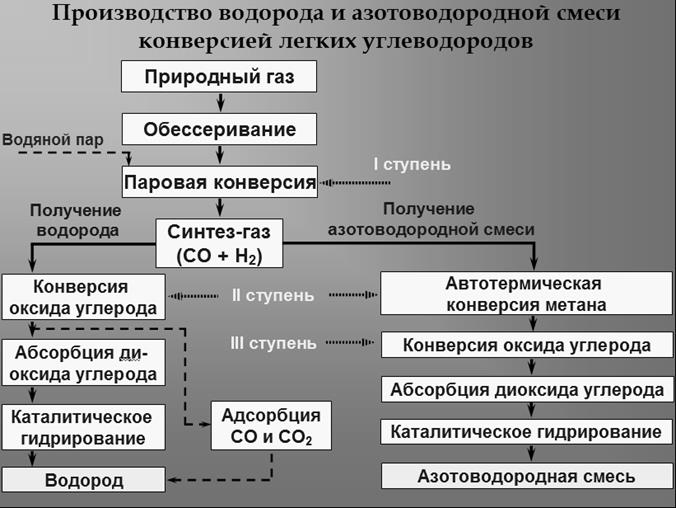
Рис.2.5. Блок-схема производства водорода и азотоводородной смеси конверсией легких углеводородов
Конкретным сырьем могут служить любые УВ газы (природные, попутные), нафта и т.п. Для получения 1 т водорода требуется 5–6,6 тыс. м3 природного газа.
Обессеривание сырья – удаление газообразных сернистых соединений, поскольку они являются сильными каталитическими ядами. Это стадия подготовки сырья для производства водорода и АВ смеси.
2.1.1. Пиролиз метана
Пиролиз метана – это умеренно эндотермический процесс разложения природного газа (органического сырья). Пиролиз метана является альтернативным подходом к получению водорода из природного газа без образования CO2 в ходе реакции: CH4→ C↓ + 2H2↑
Пиролиз – это процесс разложения метана на водород и чистый углерод, но только не в виде газа, а в твёрдом состоянии. Соответственно, углекислый газ не выбрасывается в атмосферу, а складируется в твёрдом состоянии. Данный метод не требует улавливания и подземного хранения, поэтому может применяться в качестве промышленного материала для производства углеродных материалов.
При пиролизе метана образуется водород, который может быть использован в энергетике, транспортном секторе, в промышленных/химических процессах, и для снижения выбросов загрязняющих веществ и парниковых газов, а также углерода в твердой форме.
Пиролиз метана относится к целому ряду процессов (по аналогии с конверсией метана), которые могут быть разделены на 4 больших класса – термический пиролиз, каталитический пиролиз, плазменный пиролиз, а также отдельно может быть выделен пиролиз в расплавах металлов.
В настоящее время процессы получения водорода пиролизом метана не выведены на промышленный уровень, но научные исследования ведутся по всем четырем направлениям. В то время, как компании BASF, Thyssenkrupp и Linde сосредоточились на процессе термического пиролиза, американская компания Monolith занимается плазменным пиролизом. Другой подход применяют IASS и KIT – использование жидкого металла в качестве теплоносителя. Напротив, австралийский процесс HAZER® компании Hazer Group основан на каталитическом пиролизе метана.
Для термического разложения метана необходимы высокие температуры (выше 1000°C). Использование катализатора помогает увеличить скорость реакции и таким образом снижает температуру, требуемую для конверсии природного газа. Технологической особенностью такого процесса является периодическое восстановление катализатора, что сопровождается выбросами диоксида углерода и повышает «углеродный след» получения водорода.
Плазменный пиролиз – это способ разложения метана в плазме (например, сверхвысокочастотного разряда). В этом случае в качестве источника энергии используется электроэнергия (сетевая или возобновляемая) и, соответственно, процесс не сопровождается «прямыми» выбросами диоксида углерода. Существенным преимуществом пиролиза метана является меньший удельный расход электроэнергии (оценивается менее 20 кВтч на килограмм водорода в сравнении, например, с электролизом воды.
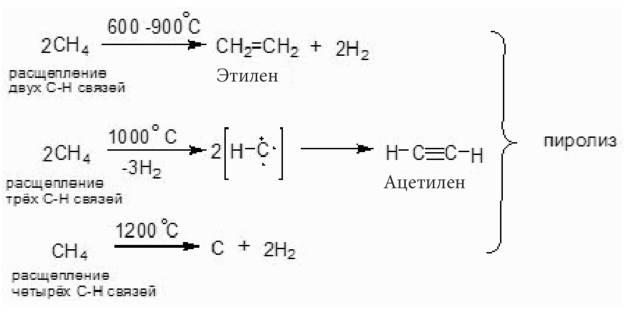
При температурах выше 600°С происходит глубокое разрушение углеродной цепи алканов с образованием этилена (600–900°С), ацетилена (-1000°С) или сажи и водорода (1100–1600°С). Изменения продуктов реакции в зависимости от температуры отчетливо видны при пиролизе метана.
Деструкция метана при температурах выше 1200°С происходит очень глубоко с разрушением всех связей С – Н, что приводит к образованию сажи (углерода) и водорода.
При частичном окислении метан и другие углеводороды в природном газе вступают в реакцию с ограниченным количеством кислорода (как правило, из воздуха), которого недостаточно для полного окисления углеводородов до углекислого газа и воды. При меньшем, чем стехиометрическое количество кислорода, продукты реакции содержат в основном водород и монооксид углерода (и азот, если реакция проводится с воздухом, а не с чистым кислородом), а также относительно небольшое количество диоксида углерода и других соединений. Затем, в реакции переноса воды-газа, окись углерода реагирует с водой для того, чтобы сформировать углекислый газ и больше водорода.
Производство водорода из природного газа или других углеводородов достигается также частичным окислением. Смесь топливо-воздух или топливо-кислород частично сгорает, что приводит к обогащению водородом синтез-газа. Водород и монооксид углерода получают в результате реакции конверсии водяного газа. Двуокись углерода может подаваться совместно для снижения отношения водорода к монооксиду углерода.
Частичное окисление является экзотермическим процессом, оно выделяет тепло. Этот процесс, как правило, намного быстрее, чем паровая конверсия, и требует меньшего объема реактора. Как видно из химических реакций парциального окисления, этот процесс изначально производит на единицу вводимого топлива меньше водорода, чем получается при паровой конверсии того же топлива.
Парциальное окисление реакции метана:
CH4+ ½O2→ CO + 2H2 (+ тепло)
Водогазовая сдвиговая реакция:
CO + H2O → CO2+ H2 (+ небольшое количество тепла)
В частичное окисление реакция происходит, когда субстехиометрический топливно-воздушная смесь или топливо-кислород частично сгорел в реакторе риформинга или частичного окисления. Различают частичное термическое окисление (TPOX) и каталитическое частичное окисление (CPOX).
Получение водорода в условиях промышленности связано с процессом выделения его из природного газа, вернее, из его основного компонента метана. Его смешивают с кислородом и паром воды. Выделение водорода происходит при высоких температурах. При нагревании смеси указанных газов до 800–900°C происходит реакция в присутствии катализатора, которая схематически может быть представлена в виде уравнения:
2CH4+ O2+ 2H2O → 2CO2+ 6H2
Затем полученную газовую смесь разделяют. Выделенный при этом водород очищается и используется или на месте получения, или транспортируется в нужное место под повышенным давлением в стальных баллонах.
Не менее важным способом получения водорода в промышленности является его выделение из газов переработки нефти или из коксового газа. Благодаря глубокому охлаждению, свойственному данному методу, все газы сжижаются, кроме водорода.
2.1.2. Производство метано-водородной смеси технологией адиабатической конверсией метана
Разработанная в России новая технология адиабатической конверсии метана существенно упрощает промышленный процесс получения метано-водородной смеси (МВС), поскольку не требует производства кислорода, энерго- и капиталозатратного электролиза воды, происходит при более низких температурах (до 680°С) и построена на отработанных в крупнотоннажной химии технологических решениях, режимах и катализаторах. Адиабатическим процессом называется процесс, идущий без теплообмена с окружающей средой
Принципиальная схема получения метано-водородной смеси по технологии адиабатической конверсии метана (АКМ) изображена на рис.2.6.
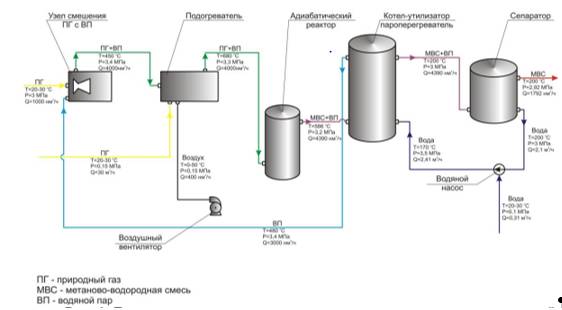
Рис.2.6. Принципиальная схема получения метано-водородной смеси
Природный газ, очищенный от сернистых соединений, поступает в узел смешения с водяным паром. Водяной пар поступает из котла-утилизатора. Природный газ с водяными парами при температуре примерно 450°С поступают в огневой подогреватель. На выходной линии огневого подогревателя температура смеси составляет примерно 680°С. С такой температурой смесь поступает в адиабатический реактор. В реакторе, благодаря адиабатической конверсии метана, получаем метано-водородную смесь и водяные пары с температурой примерно 590°С. Так как в адиабатическом реакторе часть воды тратится для получения водорода, производится постоянная подпитка воды в систему. Перед тем как попасть в систему вода проходит через фильтр. Все расходные показатели по природному газу, метано-водородной смеси, водяному пару и воде показаны на схеме.
В данной установке при подаче на вход природного газа в количестве 1000 нм3/ч, а на выходе из установки получают метано-водородную смесь в количестве 1792 нм3/ч, а компонентный состав входного природного газа и выходной метано-водородной смеси показан в таблице 2.2.
Таблица 2.2. Компонентный состав входного природного газа и выходной метано-водородной смеси
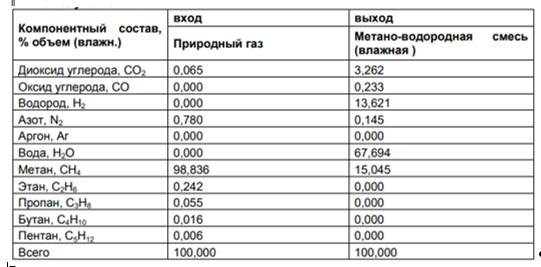
Входящий продукт (природный газ) в основном состоит из метана (99%). Выходящий продукт является смесью трех компонентов: водяного пара – 67,7% (об.), водорода – 13,6% (об.) и метана – 15%. Повышенное содержание по сравнению с входящим продуктом имеют: диоксид углерода – 3,3% и оксид углерода – 0,233%. Однако при использовании МВС в качестве топливного газа выбросы СО2 и СО уменьшаются в полтора раза. Расчеты специалистов показали, что содержание водорода в МВС может изменяться от 0 до 44–48% как путем изменения температуры нагрева парогазовой смеси, так и путем разбавления товарной МВС природным газом.
Метано-водородное топливо может быть преобразовано в дальнейшем в синтез-газ для применения в процессах газохимии (GTL), либо из него может быть выделен водород как целевой продукт для различных отраслей с помощью методов PSA (короткоцикловой адсорбции) или мембранных крупнотоннажных технологий, освоенных в мировой практике.
2.2. Газификация угля
Газификация угля – процесс высокотемпературного взаимодействия угля с парами воды, кислородом, диоксидом углерода или их смесями, с целью получения горючих газов: Н2, СО, СH4. Они могут использоваться как топливо и как сырье для химической промышленности. Газифицироваться могут практически все виды газообразных, жидких и твердых топлив. Выбор сырья для процесса обычно бывает обусловлен экономическими соображениями, а иногда – направлением дальнейшей переработки образующейся газовой смеси.
Существуют различные типы процессов газификации углей. Наиболее эффективным и отработанным в промышленном масштабе, является процесс газификации угля под давлением, позволяющий получать как средне калорийный бытовой газ, так и газ для последующего синтеза. Существуют различные технологии газификации углей, отличающихся организацией процесса взаимодействия топлива и окислителя. Например, газификация с неподвижным или псевдоожиженным слоем или же со с путным потоком пылевидного топлива. Газификация проводится в специальных аппаратах – газогенераторах, которые также отличаются друг от друга в зависимости от типа процесса. При использовании воздушного дутья получается низкокалорийный газ (до 7 МДж/м3), в случае кислородного дутья – средне калорийный газ (до 17 МДж/м3). В то время как генераторы с воздушным дутьём работают при атмосферном давлении, генераторы с кислородным дутьём работают преимущественно при повышенных давлениях, что приводит к увеличению выхода метана.
Газификацией твердого топлива с парокислородным дутьем происходит под высоким давлением при температуре около 1500°С и последующим метанированием. На рис.2.7 схематически показаны реакционные зоны газификатора. В нижней части реактора непосредственно над колосниковой решеткой, через которую непрерывно поступает газифицирующий компонент (перегретый пар и кислород), находится зона горения (окислительная зона) с основными реакциями образования СО2. Над ней расположена первичная восстановительная зона (зона теплопоглощения) с основными реакциями раскалённого углерода и водяного пара, в которой генерируется Н2. Еще выше находится вторичная восстановительная зона (зона прогрева топлива) с основными реакциями образования СО, СО2 и Н2.
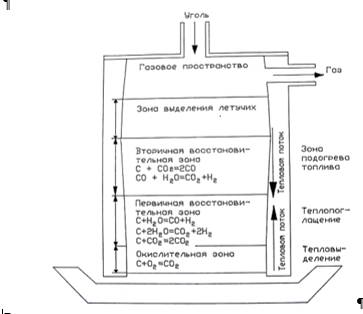
Рис.2.7. Реакционные зоны в газогенераторе
Образовавшийся в окислительной и восстановительных зонах диоксид углерода (при недостатке кислорода) восстанавливается новыми порциями углерода в оксид углерода СО. При взаимодействии СО и Н2 может образовываться метан, который в процессе подвергается термическому распаду СО + 3Н2 = СН4 + Н2О + 203,7 МДж/кмоль, СН4 = С + 2Н2–71,1 МДж/кмоль.
В верхней части реактора имеется газовое пространство с газ выпускным отверстием. Ниже располагается зона выделения летучих или зона полукоксования. Сочетание всех этих основных реакций определяет состав образующегося газа, который изменяется по высоте газификатора. Таким образом, генераторный газ обычно получают продуванием смеси воздуха или кислорода с паром через слой угля, организуя неполное сгорание топлива.
При анализе реакционных зон (без учёта зольной зоны над колосниками) в противоточной установке можно выделить три основные зоны. В нижней зоне происходит окисление угля до СО2 (окислительная зона), в средней зоне СО2 восстанавливается до СО (восстановительная зона). Эти зоны вместе называются зоной газификации, из которой выходят горячие газы с температурой 800–900°С. Они нагревают уголь, который подвергается пиролизу в вышележащей зоне. Эту зону принято называть зоной пиролиза (зоной выделения летучих), или зоной полукоксования. Выходящие из этой зоны газы подогревают уголь в зоне сушки. Вместе эти две зоны образуют зону подготовки топлива. В газификаторе протекают как экзотермические, так и эндотермические реакции. При этом отношение СО/СО2 зависит от различных факторов: избытка воздуха, температуры процесса и способа контактирования части топлива с окислителем и других.
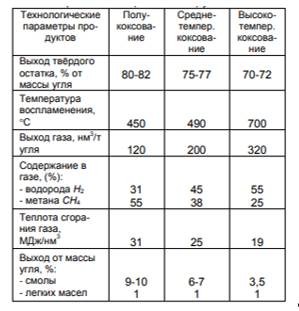
В таблице 2.3 приведены характеристики продуктов термического разложения при различных температурах.
Таблица 2.3. Характеристики продуктов термического разложения (коксования) углей
Паровоздушная газификация крупнокускового топлива для получения отопительного газа осуществляется в стационарных газификаторах прямого процесса с непрерывным процессом в плотном слое, как в установках атмосферного давления с гидравлическим затвором и твердым шлакоудалением, так и в установках под давлением (процесс Лурги).
Паровоздушная газификация мелкозернистых топлив осуществляется в кипящем слое. Газификация пылевидного топлива на паровоздушном дутье практически осуществляется путем неполного сгорания в прямоточном факеле.
Видно, что в разных температурных режимах процесса газификации можно получать различные продукты, которые могут быть отобраны из газификатора после прохождения их через зоны постепенно снижающихся температур при противотоке топлива и газов (прямой процесс) или после пропускания их через зоны повышающихся температур при параллельном токе топлива и газов (обратный процесс).
Коксование- разновидность сухой перегонки (пиролиза) каменного угля без доступа воздуха, с целью получения кокса, горючих газов и сырья для химической промышленности.
Под процессом полукоксования понимают термическую переработку угля при 500–600°С, среднетемпературное коксование – при 700–800°С, высокотемпературное коксование – при 950°С и выше.
В настоящее время существует более 70 типов газогенераторных процессов, часть которых используется в промышленных масштабах. Это объясняется прежде всего различием физических и химических свойств угля из разных месторождений: по элементарному составу, происхождению, содержанию летучих веществ, содержанию и составу золы, влажности, соотношению Н/С в угольной массе, спекаемости углей, их термической стойкости. Не менее существенным является и различие во фракционном составе добываемых углей: крупнокусковой уголь, угольная мелочь, топливная пыль. Наконец, различаются требования к получаемому конечному продукту:
–генераторный (энергетический) газ с теплотой сгорания 3800–4600 кДж/нм3;
–синтез-газ (технологический) для химической технологии с теплотой сгорания 10 900–12 600 кДж/нм3;
–восстановительный газ (для металлургических и машиностроительных производств) с теплотой сгорания 12 600–16 800 кДж/нм3;
–городской газ (отопительный) с теплотой сгорания 16 800–21 000кДж/нм3;
–синтетический природный (богатый) газ для транспортировки на дальние расстояния – 25 000–38 000кДж/нм3.
При всем своем многообразии процессы газификации делят на два основных класса.
1. Автотермические процессы газификации, в которых тепло, необходимое для проведения эндотермических процессов, для нагрева газифицируемого материала и газифицирующих средств до температуры газификации (900–1200°С), производят за счет сжигания в кислороде части газифицируемого топлива до диоксида углерода.
2. Аллотермические процессы газификации, в которых сжигание и газификация разделены, и тепло для обеспечения прохождения процесса газификации подводится через теплопередающую стенку внутри единого газогенераторного объема или при помощи автономно нагретого теплоносителя, который вводится в газифицируемую среду.
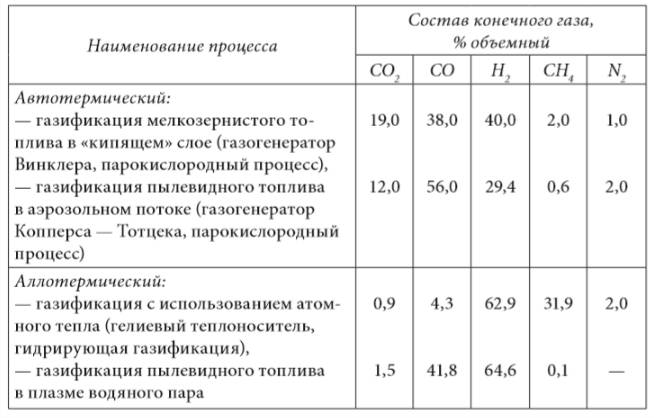
Типичные составы газов, получаемых в автотермических и аллотермических процессах представлен в таблице 2.4.
Таблица 2.4. Типичные составы газов, получаемых в автотермических и аллотермических процессах
Как автотермические, так и аллотермические процессы газификации в зависимости от зернистости топлива могут протекать в плотном и «кипящем» слоях (крупнокусковое топливо), в аэрозольном потоке (топливная пыль). Эти принципы проведения гетерогенных процессов, разработанные в газогенераторной технике, получили широкое применение в химической технологии при проведении, например, гетерогенных каталитических процессов.
Для всех этих производств характерны большие единичные мощности агрегатов и отсутствие ограничений по потокам энергии. Общий вид промышленной установки газификации угля представлен на рис.2.8.

Рис.2.8. Установка газификации угля
Параметры, определяющие активность и скорость процессов газификации:
–тип газифицирующего агента: воздух, водяной пар, кислород;
–температура и давление процесса: Т=850–2000°С, р=0,1–10МПа;
–способ образования минерального остатка и его удаление: высокотемпературный процесс (1300–1400°С, зольная часть угля из генератора выводится в виде жидкого шлака, конечный продукт газификации-смесь СО+Н2; низкотемпературный или среднетемпературный процесс (1200–1250°С), зольная часть угля из генератора выводится в сухом виде;
–способ подачи газифицирующего агента: оксогазификация и гидрогазификация;
–способ отвода тепла в реакционную зону: автотермическое, аллотермическое.
К настоящему времени освоены различные модификации промышленных процессов газификации углей, наиболее распространенными из которых являются процессы Лурги (стационарный слой кускового угля), Винклера (кипящий слой угольных частиц), Копперс–Тотцека (пылеугольный поток) и их различные модификации. На опытно-промышленном уровне сейчас отрабатывается около 20 технологий газификации угля нового поколения.
2.2.1. Процесс Лурги
Газогенераторы Лурги являются одним из старейших типов газогенераторов, которые до сих пор широко используется в мире. Они работают на всем спектре углей, от антрацита до бурых углей. На рис.2.9 представлена принципиальная схема газогенератора.
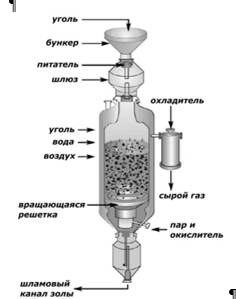
Рис.2.9. Схема газогенератора Лурги
Уголь находится в реакционном объеме газогенератора примерно 1 час пока окислитель и пар протекают через решетку и слой угля. На рис. 2.10 показано как уголь и газы движутся навстречу друг другу.
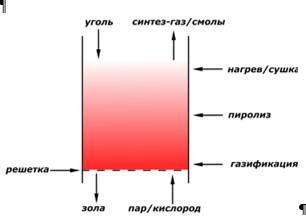
Рис.2.10. Противоточное движение газ/твердое топливо
Это делает устройство газогенераторов Лурги энергоэффективной технологией газификации. Наибольшие температуры (от 615 до 760°С) достигаются сразу над решеткой, где и происходит газификация кокса. Горячие газы поднимаются вверх и поступают в камеру охлаждения, которая расположена выше зоны газификации. В средней части слоя, поднимающиеся горячие газы пиролизуют уголь, в результате чего образуются пиролизные смолы и кокс. В верхней части слоя (самый холодный участок) уголь нагревается и сушится перед поступлением в зону пиролиза. Синтез-газ и смолы выходят из реактора при температуре 370–590°С. По сравнению с другими процессами газификации, рабочие температуры в газогенераторах Лурги относительно низкие, в связи с чем не требуется их футеровка.
Вследствие того, что слой должен быть свободно движущимся, в газогенераторах такого типа могут использоваться только неспекающиеся марки углей. Высокодисперсное топливо в данной технологии не используется, т.к. мелкие частицы локально затыкают межпоровое пространство между большими кусками угля, ухудшая тем самым газодинамические свойства слоя. Средний фракционный размер используемого топлива составляет ~30 мм, что является недостатком данной технологии, т.к. требует дополнительной операции сортировки (просеивание) поступающего угля. Газогенераторы Лурги производят значительное количество смол (в зависимости от марки угля до 30% органической массы), затрудняющих их эксплуатацию, в частности это приводит к ограничению срока службы шлюзовой камеры, что является еще одним недостатком. Покидающие реактор горячие газы охлаждаются циркулирующим потоком воды. Жидкость после охладителя, состоящая из большого количества смол и надсмольной воды, используется для дальнейшего производства органических жидкостей. Надсмольная вода содержит водорастворимые соединения смол, включая фенол и крезоловую кислоту (смесь изомеров метилфенолов).
Увеличение давления позволяет существенно повысить теплоту сгорания получаемого газа за счет протекания реакций метанирования. Эти реакции экзотермичны, благодаря чему при давлении 2,8–3 МПа можно сократить потребность в кислороде на 30–35%. Кроме того, одновременно возрастает производительность газогенератора (пропорционально давлению) и повышается КПД газификации.
Этот технологический процесс доказал свою коммерческую успешность, а получаемая продукция особенно хорошо подходит для использования в производстве синтетического природного газа или восстановлении железной руды (ГБЖ).
Недостатки метода Лурги:
–жесткие ограничения по размерам частиц – не менее 5 мм (так как при большом содержании мелочи снижается производительность аппарата);
–наряду с газификацией происходит термическое разложение топлива с образованием продуктов полукоксования, которые необходимо извлекать из газа и перерабатывать;
–низкая степень разложения водяного пара (30–40%), вследствие чего остальное его количество при охлаждении газа конденсируется с образованием химически загрязненной воды, требующей тщательной очистки.
2.2.2. Процесс Копперса-Тотцека
В процессе Копперса-Тотцека твердые топлива газифицируют кислородом и водяным паром при нормальном давлении в режиме прямотока (т.е. сырье и газифицирующий агент движутся в одном направлении). На рис.2.11 представлена общая схема газификаторов такого типа. Первая промышленная установка была введена в эксплуатацию в 1952 году в Финляндии. Эта технология позволяет перерабатывать любой уголь, причем его фракционный состав не должен превышать 0.1 мм. Температура размягчения золы имеет непринципиальное значение, так как данная технология основана на жидком шлакоудалении. Пылевидный уголь (верхний предел зольности по экономическим соображениям составляет около 40% на сухую массу угля, а влажность – 6–8% для бурых и 1–2% для каменных углей) потоком азота подается в расходные бункера, откуда шнеком направляется в форсунки, захватывается потоком кислорода и водяного пара и распыляется в камеру.







