
Клеменс Арвай
История иммунной системы
Часть 1
Родоначальники иммунной системы
Глава 1
Бактерии против вирусов: иммунная система микробов
Говоря об иммунной системе, мы обычно представляем себе защитный механизм, работающий против возбудителей болезней, таких как бактерии, вирусы или грибки. Но эти микробы тоже обладают собственными иммунными функциями, так как сами могут стать жертвами болезнетворных микроорганизмов или паразитов. Давайте отправимся в путешествие по микрокосму, в котором бактерии охотятся друг на друга и всеми силами защищаются от атак. Полем этих ожесточенных сражений микробов являются водоемы, почва, растения, организм животных и даже наш собственный кишечник. Обратим свой взгляд также на целый мир существ, передвигающихся по поверхности лесной подстилки, полусгнившим стволам деревьев и в воде. Эта глава рассказывает о самых архаичных формах иммунитета, без которых не было бы ни нас самих, ни нашей иммунной системы. Многие древние с эволюционной точки зрения организмы, с которыми мы встретимся на следующих страницах, будут играть важную роль и в ходе последующего изучения человеческой иммунной системы. Ведь бактерии не только вызывают заболевания, но и предотвращают их развитие. Иммунные клетки кишечника защищают организм от патогенных бактерий и вирусов при содействии микрофлоры. Микробиота кишечника играет важную роль в поддержании иммунитета.
Первобактерии, сине-зеленые бактерии и «современные» бактерии
Цианобактерии, древнейшие живые организмы, скорее всего, обладали простейшими оборонительными стратегиями против вредных воздействий извне. Их самые ранние формы, обнаруженные в ископаемых образцах, появились примерно 3,5 миллиарда лет назад, в палеоархейскую эру. Эти сине-зеленые бактерии, которые раньше называли также сине-зелеными водорослями, до сих пор населяют воды и почву нашей планеты. На протяжении огромного периода времени – от 2,2 до 2,7 миллиарда лет – цианобактерии играли существенную роль в формировании стабильной и пригодной для жизни атмосферы, вырабатывая кислород. Эти одноклеточные создания овладели одной из форм фотосинтеза, в ходе которого им удавалось использовать для выработки кислорода более широкий спектр солнечного света, чем большинству других зеленых растений. Цианобактерии дали начало более поздним видам бактерий, большинство из которых уже не осуществляют фотосинтез.
Сами по себе цианобактерии никогда не были возбудителями инфекционных болезней, хотя они и производят токсины, способные причинить вред человеку или животным (риск возникает, например, при питье воды, зараженной этими ядовитыми веществами). Но так называемые цианотоксины могут представлять опасность для людей и животных только в том случае, если их концентрация в воде слишком велика. Это может произойти, к примеру, в случае попадания в водоем слишком большого количества удобрений, применяемых в сельском хозяйстве, или сброса сточных вод промышленными предприятиями. В этом случае переизбыток азота приводит в хаос весь живой мир водоема и становится причиной чрезмерного роста цианобактерий и водорослей. Такой процесс называют иногда цветением водорослей. Повышенная концентрация азота приводит к тому, что некоторые виды микроорганизмов, которые раньше находились в стабильном равновесии с другими конкурирующими видами, начинают вытеснять и уничтожать своих соседей. В результате разрушается и их собственная среда обитания. В итоге экосистема отравляется и погибает. Только при таких условиях экологической деградации, когда цианобактерии бесконтрольно размножаются, а их среда обитания выходит из равновесия, выделяемые ими токсины начинают представлять опасность и для нас. Обычно же эти бактерии составляют часть нашего микробиома и даже живут у нас в кишечнике[1].
И цианобактерии, и «современные» бактерии имеют ДНК, но в них нет клеточного ядра. ДНК (дезоксирибонуклеиновая кислота, носитель генетического кода) свободно размещается внутри клетки. Поэтому бактерии называют прокариотами (от греч. pro – «до», «раньше» и karyon – «ядро»). Другими словами, они появились в тот период развития жизни, когда на Земле в клетках живых существ не было ядер. К этой же группе принадлежат и археи – их биологи раньше именовали первобактериями, или архебактериями. Они представляют собой самостоятельную форму жизни, и их не следует смешивать с обычными бактериями. Как считает наука, они не имеют родственных связей ни с цианобактериями, ни с современными бактериями, хотя по возрасту (3,5 миллиарда лет) примерно совпадают с цианобактериями.
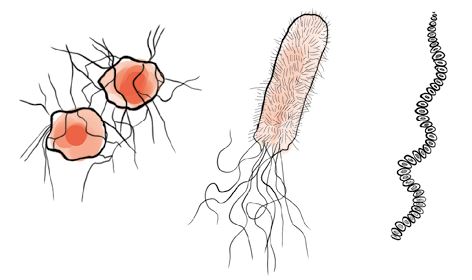
Археи, цианобактерия и «современная» бактерия (слева направо)
Археи обитают преимущественно в экстремальных условиях, к примеру в гейзерах, областях вулканической активности с их высокими температурами, в очень соленой воде, как, например, в Мертвом море, или экстремально кислой среде типа вулканических и болотных почв. До сих пор среди этих реликтов древнейших времен не было найдено ни одного возбудителя болезней, которые могли бы представлять опасность для людей или животных. Они интересны главным образом с экологической точки зрения, и я имею в виду не только то, что они живут в самых экстремальных местах планеты.
В соответствии с последними биологическими изысканиями археи имеют важное значение как симбионты экосистемы «человек». Будучи способными обитать в самых экстремальных условиях, они будто специально созданы для того, чтобы жить в человеческом кишечнике с малым содержанием кислорода. И их там действительно обнаружили. Они поддерживают обмен веществ наших кишечных бактерий и разлагают токсичные вещества, представляющие собой побочные продукты этой деятельности[2]. В частности, они выводят из организма триметиламин, который образуется в процессе обмена веществ наших бактериальных симбионтов, особенно после потребления продуктов животного происхождения. Бактериальные яды имеют обыкновение накапливаться и повышают риск развития сердечно-сосудистых заболеваний, атеросклероза, инфаркта миокарда или инсульта.
Таким образом, археи выполняют важные функции по поддержанию здоровья в нашем кишечном микробиоме, отвечая за его сбалансированность. Их долю в микробиоме называют археомом. Выходит, мы живем в симбиозе с реликтами древнейших времен, чьи родственники обитают в гейзерах, на краю вулканических кратеров или в Мертвом море.
Бактерии можно сегодня найти повсюду в почве, водоемах, а также в растениях и организмах животных и человека, то есть в любых экосистемах и областях обитания. Многие из них выполняют важные экологические функции в природе, являются нашими симбионтами (например, в кишечнике или на коже), но могут также как возбудители болезней представлять потенциальную опасность для других видов живых существ. Самая старая из найденных учеными живых бактериальных клеток имеет возраст 250 миллионов лет. Этот Мафусаил микрокосма находился со времен раннего мезозоя в кристалле соли на 600-метровой глубине под поверхностью Земли, что обеспечивало ему безопасность от вредных воздействий окружающей среды и патогенов. Это и позволило ему прожить так долго[3]. Будучи самыми маленькими живыми существами на нашей планете, бактерии имеют и другие возможности защиты от опасностей, которые таит в себе их среда обитания, и не полагаются только на соляные кристаллы.
Пожиратели бактерий
Бактерии могут стать жертвами заражения вирусами. Особые формы вирусов называются бактериофагами, что в переводе означает «пожиратели бактерий». Их головка, так называемый капсид, содержит генетическую информацию вируса и похожа по форме на космическую капсулу. Она закреплена на дискообразной структуре, так называемом воротнике, к которому прикреплен также хвост, способный растягиваться и сокращаться, словно меха гармони. К концу хвоста прикреплен еще один диск – базальная пластинка, заканчивающаяся шиповидным белком. С ее краев свисают отростки, напоминающие ноги паука. При более подробном рассмотрении бактериофага становится очевидным, что вирусы не являются живыми существами.

Бактериофаг присоединяется к бактерии
Бактериофаги, или просто фаги, являются своего рода роботами или зондами, обладающими ДНК. Они состоят только из генетической информации в форме ДНК, содержащей план их строения, и простой капсулы, или оболочки. Кроме того, они располагают техническими инструментами для введения ДНК в клетку организма-хозяина (для бактериофага таким хозяином будет бактерия), после чего эта клетка на основании «чертежа» начинает заниматься воспроизводством вируса. Это напоминает взлом компьютера хакером, который перепрограммирует генетические процессы в других живых существах с целью воспроизводства бесчисленного количества копий самого себя. Поэтому вирусам и не нужен свой обмен веществ. У них нет необходимости принимать и переваривать пищу, выделять продукты жизнедеятельности и размножаться собственными усилиями. В отличие от бактерий, они неспособны делиться или объединяться с другими вирусами с целью размножения. С позиции биологии размножение и обмен веществ относятся к необходимым предпосылкам, позволяющим назвать биологическую структуру живым существом. Правда, некоторые биологи все же считают вирусы «близкими к живым существам» образованиями.
Таким образом, вирусы – это лишь капсулы, с помощью которых план их строения доставляется в другие организмы, словно в копировальные машины. Причудливый вид бактериофагов, напоминающих микроскопических роботов с ножками, словно у пауков, только подчеркивает их непохожесть на живых существ. У некоторых вирусов генетический план содержится не в ДНК, а в РНК (рибонуклеиновой кислоте). Среди бактериофагов тоже попадаются представители РНК-вирусов.
Большинство бактерий имеют размеры от 2 до 6 тысяч нанометров, то есть 0,002–0,006 миллиметра. По сравнению с ними бактериофаги, как и другие вирусы, достигают в размерах лишь 30–200 нанометров (от 0,00003 до 0,0002 миллиметра). Таким образом, в масштабах микрокосма бактерии – настоящие гиганты по сравнению с вирусами. Они больше в 30–70 раз. На поверхности клеток у бактерий находятся, как и у вирусов, белки. К ним и присоединяются бактериофаги, заражая бактерию с помощью окончания своего хвоста. Хвост бактериофага может сжиматься, благодаря чему капсула с генетическим материалом приближается к бактерии. При этом ДНК или РНК с помощью белкового шипа впрыскивается внутрь бактерии. А затем оболочка бактериофага вместе со всеми вспомогательными инструментами сжимается и опадает.
После этой инъекции для бактерии, как и для человека, начинается инкубационный период, в течение которого возбудитель уже находится в клетке, но пока никак не проявляет себя. Длительность его для бактерии составляет после заражения бактериофагом несколько часов. Для сравнения: у человека, зараженного вирусом гриппа, этот период длится один-два дня, а при заражении коронавирусом – от четырех до семи дней. Все это время внутри инфицированной бактерии «созревает» генетический материал бактериофага. Там происходит то же самое, что и при любой вирусной инфекции, какое бы живое существо она ни затронула: генетическая информация вируса попадает в рибосомы клетки-хозяина. Это крошечные фабрики белка. Здесь производятся все белки, необходимые организму. Такой процесс называется биосинтезом. Сюда вирусы поставляют свои генетические «чертежи», чтобы протеиновые фабрики клетки-хозяина вместо собственных белков начали производить белки вируса, из которых затем прямо в клетке собираются новые вирусы. После этого они покидают зараженную клетку. Этот процесс в бактериях ничем не отличается от того, что происходит в организме зараженного человека, волка или рыбы данио рерио. Вирусы используют клетки своего хозяина в качестве копировальных машин для размножения, подсовывая им собственные «чертежи».
Правда, бактерии, в отличие от человека, волка или рыбы, представляют собой одноклеточные организмы. Будучи инфицированы бактериофагом, они перепрограммируются настолько, что в ущерб себе производят несколько сотен новых бактериофагов, а затем погибают. Таким образом, вирусные инфекции для бактерий особенно опасны.
Как бактерии защищаются от вирусов
Многие иммунные функции бактерий, направленные на защиту их от бактериофагов, к настоящему времени хорошо изучены. Их можно назвать врожденной иммунной системой[4]. Это значит, что бактерии уже в момент своего возникновения генетически оснащены ею. У людей и всех других форм жизни также имеются подобные врожденные иммунные функции, которые не приходится приобретать на протяжении жизни. Конечно, наш иммунитет намного эффективнее и сложнее, чем у бактерий, но бактерии также обладают простейшими защитными средствами.
Во-первых, у многих бактерий имеются внешние барьеры, затрудняющие бактериофагам процесс присоединения. Для этого они могут, к примеру, закапсулироваться, создав таким образом механический барьер между собой и окружающим миром. Тот самый кристалл соли, в котором самая старая из ныне живущих бактериальных клеток находилась 250 миллионов лет, тоже, по сути, защитная капсула. Еще одна возможность защиты – это скопление молекул на поверхности клетки, также образующих барьер. Говоря об этой иммунной функции, можно вспомнить о коже человека и других млекопитающих или слое слизи на слизистой оболочке, препятствующих проникновению возбудителей болезней в организм.
Эта простая механическая защитная функция наглядно демонстрирует, что иммунная система, впервые возникшая еще у одноклеточных организмов, представляет собой по сути экологическую систему, которая призвана распознавать воздействия окружающей среды как безвредные или вредные и обеспечивать защиту от последних. Как мы вскоре убедимся, сформированный в процессе эволюции наш собственный иммунный механизм, куда более сложный, представляет собой такую же экологическую систему.
Во-вторых, бактерии демонстрируют устойчивость к адсорбции. Это значит, что определенные белки на поверхности клетки, к которым могут присоединяться бактериофаги, удаляются или видоизменяются таким образом, что устраняется «замочная скважина», через которую проникает инфекция. Такая форма иммунитета есть и у более высокоорганизованных форм жизни, в том числе и у человека. Правда, она срабатывает только в случае, если предки данного организма уже имели контакт с определенным возбудителем. Таким образом, речь идет о своего рода унаследованном коллективном иммунитете, в том числе и у бактерий.
В-третьих, есть возможность обездвижить бактериофаг уже после его присоединения к бактерии-хозяину в случае, если внешние барьеры не сработали. Клетка бактерии может распознать начавшийся процесс проникновения в нее, реагируя на определенные белки, молекулы сахаров или специфические структуры возбудителя. В ответ на это она вырабатывает противоядие, которое лишает бактериофаг возможности двигаться, так что он не может завершить процесс проникновения в бактерию. Образно говоря, подвергшаяся нападению бактерия обстреливает захватчика стрелами с парализующим ядом, и эта космическая капсула, пожирающая бактерии, выходит из строя. Даже на более поздней стадии, когда бактериофаг уже проник внутрь бактерии, она все еще может парализовать агрессора и остановить процесс инфицирования.
В-четвертых, бактерия способна распознать генетический материал бактериофага и попытаться обезвредить его путем уничтожения или изменения, пока он не превратил бактериальную клетку в фабрику по производству вирусов. В этом случае бактерия как бы обращает оружие вируса против него самого и модифицирует впрыснутый генетический материал, пока тот не сделал то же самое. При этом сохраняется собственная ДНК бактерии, которая находится, как мы помним, не в ядре, а во внутриклеточной плазме.
Большой интерес представляет пятый защитный механизм бактерий, так как он основан на сотрудничестве и представляет собой прототип нашей собственной иммунной системы. Для того чтобы ограничить размножение бактериофагов, бактерия помечает напавшего на нее возбудителя определенными веществами. Другие родственные бактериальные клетки распознают маркированные бактериофаги и уничтожают их. Правда, самόй подвергшейся нападению бактерии это уже не может помочь, но воздействие возбудителей на популяцию бактерий в целом удается ослабить.
Этот процесс интересен тем, что он представляет собой прототип так называемой опсонизации, играющий важную иммунобиологическую роль у многочисленных форм жизни, включая и людей. Он заключается в том, что наша иммунная система помечает вирусы или бактерии специальными белками из плазмы крови. На эту маркировку реагируют остальные клетки нашей врожденной иммунной системы, например фагоциты и нейтрофилы, выполняющие функции неотложной помощи. Эти клетки удаляют маркированных возбудителей, даже не прибегая к образованию антител.
Процесс основывается исключительно на механизмах врожденного иммунитета и был впервые изобретен бактериями – простейшими формами земной жизни. По аналогии с популяцией бактерий мы можем рассматривать свой организм как популяцию различных взаимодействующих друг с другом высокоспециализированных клеток. Для каждой из них, включая фагоциты и нейтрофилы, наше тело представляет собой среду обитания. Для нас опсонизация, то есть маркировка возбудителей с их последующим уничтожением защитными клетками, является способом избежать инфекций и выжить. В мире бактерий все иначе. Их среда обитания – это не многоклеточный организм, а, например, вода. Маркировка опасных бактериофагов с их последующим устранением направлена на защиту популяции, а не какой-то одной конкретной бактерии. Если довести эту мысль до конца, то можно сказать, что наш организм соответствует среде обитания, например морю, в котором живет множество отдельных клеток. Чтобы сохранить эту среду и тем самым свою популяцию, клетки сотрудничают друг с другом, защищаясь от возбудителей болезней, даже если сами погибают в этой борьбе. А уцелевшие – это мы: люди, животные, растения, которые стали средой обитания для хорошо организованных популяций клеток.
Шестой защитный механизм бактерий представляет особый интерес в плане истории иммунных систем, потому что он используется нами и всеми другими многоклеточными организмами в повседневной борьбе за сохранение здоровья. Этот важнейший механизм заключается в программируемой смерти клеток. Клетки нашего тела постоянно обновляются, что позволяет органам регенерировать и сохранять свои функции. Старые клетки уступают место новым. Если состарившаяся или подвергшаяся нападению возбудителей болезни клетка отказывается умирать, в дело вступает наш врожденный иммунитет и сам убивает ее. Эту задачу берут на себя клетки, носящие название естественных киллеров, о которых речь еще впереди. После этого отмершие клетки удаляются, перерабатываются, а то, что от них осталось, вновь пускается в дело. Например, с помощью фагоцитов, о которых также будет подробно рассказано ниже.
Программируемая (добровольная) смерть зараженных клеток идет на пользу всему клеточному сообществу, и ее эволюционные истоки мы находим у бактерий. После нападения бактериофагов они могут затормозить развитие инфекции с помощью генетической программы, носящей название апоптоз. Биологи нередко описывают этот процесс как «программу самоубийства клеток». Зараженная бактерия начинает производить энзимы, растворяющие ее внутренние структуры, прежде всего мембрану, так что клетка в конечном итоге разрывается на части, и развитие в ней инфекции прекращается. Правда, сама бактерия погибает, но это идет на пользу всей популяции. Точно так же программа самоубийства отдельных клеток в нашем организме, представляющих угрозу для здоровья, идет на пользу всем остальным.
Целые популяции бактерий могут быть невосприимчивыми к определенным бактериофагам, с которыми уже контактировали ранее их «предки». Для этого они, подобно археям, «изобрели» в ходе эволюции программу, которая соответствует разработанной человеком технологии CRISPR-Cas. Ее суть состоит в том, что ДНК целенаправленно разделяется на части и изменяется. Этот процесс называется редактированием генома. Биотехнологи подсмотрели этот метод у бактерий. Сегодня он широко применяется в исследовательской работе и генных технологиях для внесения в ДНК целенаправленных изменений.
Современные бактерии, как и археи и цианобактерии, способны в рамках редактирования генома вырезать определенные последовательности из наследственного материала опасных бактериофагов и встраивать их в свою ДНК в качестве своего рода архива возбудителей[5]. Если после этого бактериофаг атакует бактерию, то генетический материал агрессора сверяется с архивом. При совпадении из архива извлекается дополнительная информация, в том числе данные о том, какие защитные меры необходимо предпринять. В частности, из архива считывается генетическая программа создания иммунопротеина, который нужен для выведения возбудителя болезни из строя. Задача этого активированного белка заключается в том, чтобы расчленить генетический материал опасного бактериофага в строго определенных местах. Тем самым предотвращается перепрограммирование клетки и превращение ее в фабрику по производству вирусов.
Самое удивительное в этом процессе редактирования генома то, что он основывается на опыте. Бактерии и археи, которые контактировали с возбудителем болезни и смогли найти защиту против него, архивируют соответствующую информацию в своей ДНК. Поскольку ДНК передается по наследству, все последующие поколения этой бактерии будут снабжены информацией о возбудителе и мерах по борьбе с ним. С каждым новым поколением архив расширяется и дополняется. Хотя речь в данном случае идет о врожденной иммунной функции, она основывается на способности к обучению, передаваемой генетическим путем.
Бактерии могут размножаться слиянием или делением. При делении из одной бактерии получаются две генетически полностью идентичные друг другу, то есть клоны. В популяции бактерий это приводит к экспоненциальному росту: из 2 бактерий получаются 4, из 4–8, затем 16, 32, 64, 128 и т. д. Уже вскоре популяцию бактерий можно увидеть невооруженным глазом на лабораторной питательной среде, хотя каждая составляющая ее клетка имеет микроскопические размеры. Если учесть, что все образовавшиеся в ходе деления бактерии генетически идентичны, то можно рассматривать их в совокупности как один организм, который развивается не только в пространственном измерении, но и во временнόм. Это значит, что в результате деления появляются все новые клоны, хотя первоначальная бактерия, от которой они произошли, может уже и не существовать.
Можно ли считать эти клоны «другими»? Или они все-таки являются «той же самой» бактерией? Дело в том, что при делении не возникает двух новых бактерий на месте одной старой. Скорее одна бактерия превращается в две. При этом ничто не теряется. Если рассматривать популяцию бактерий, образовавшуюся путем деления, как единый организм, растущий во временном измерении, то обучаемость иммунной системы популяции приобретает новое значение. В этом случае генетический архив возбудителей и соответствующих мер защиты от них можно считать самой ранней и древней формой приобретенного иммунитета. В ходе эволюции этот механизм был доведен до совершенства в многоклеточных организмах, в том числе и человеческом, отдельные клетки которого живут в тесной связи друг с другом. Но начало этому развитию положила обучаемость бактериальной иммунной системы с ее основанным на опыте архивом возбудителей и соответствующих стратегий защиты.
Почти везде, где живут бактерии, мы встречаем и бактериофагов. Их популяции в океанах по численности больше, чем любых других микробов. Они образуют там так называемый вириопланктон, то есть планктон, состоящий из вирусов. Везде, где бактериальные процессы представляют важность для людей, бактериофаги могут выступать в роли «вредителей». Если они заразят молочнокислые бактерии в закваске для производства сыра и других молочнокислых продуктов, это может стать серьезной проблемой и привести к убыткам в молочном хозяйстве. Мы только начинаем осознавать важность бактериофагов в человеческом микробиоме. Эта тема еще требует многолетних интенсивных исследований.


