Александр Марков
Рождение сложности. Эволюционная биология сегодня: неожиданные открытия и новые вопросы
Оболочка
Все организмы дискретны в пространстве и имеют наружную оболочку. Трудно представить себе живое существо в виде туманного облачка или раствора (разве что в фантастическом романе). Однако поначалу преджизнь существовала именно в виде растворов. Чтобы не раствориться окончательно, не рассеяться в водах древних водоемов, "живые растворы" должны были ютиться в крошечных полостях, которые часто встречаются в минералах. Это тем более удобно, что некоторые минералы (например, пирит) являются неплохими катализаторами для многих биохимических реакций. Кроме того, поверхность минералов могла служить своеобразной матрицей, основой, к которой прикреплялись молекулы РНК. Упорядоченная структура кристаллов помогала упорядочить и структуру этих молекул, придать им нужную пространственную конфигурацию.
Но рано или поздно преджизнь должна была обзавестись собственными оболочками – перейти от доорганизменного уровня к организменному. Идеальным материалом для таких оболочек являются липиды (жиры), молекулы которых способны образовывать на поверхности воды тончайшие пленки. Если взболтать такую воду, в ее толще образуется множество мелких пузырьков – водяных капелек, покрытых двухслойной липидной оболочкой (мембраной). Эти капельки проявляют интересные свойства, которые делают их похожими на живые клетки. Например, они способны осуществлять обмен веществ. Липидные мембраны обладают избирательной проницаемостью: одни молекулы сквозь них проходят, другие – нет. Благодаря этому одни вещества втягиваются в каплю, другие выводятся, третьи – накапливаются внутри. Правда, для того, чтобы это происходило постоянно, одних мембран недостаточно. Нужно еще, чтобы внутри капли одни вещества превращались в другие, а для этого там должны находиться катализаторы – белки или РНК.
Изучением свойств водно-липидных капель (коацерватов) занимался академик А. И. Опарин. Он считал, что коацерваты были одним из этапов на пути возникновения жизни. Опарин обнаружил, что при определенных условиях коацерваты могут расти и даже "размножаться" делением[18].
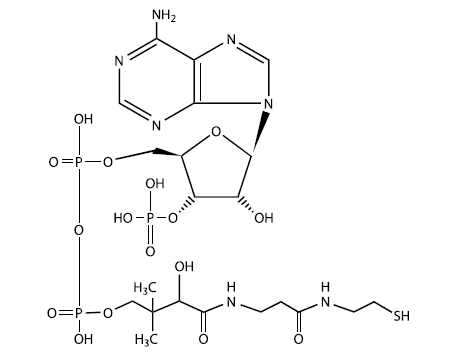
Кофермент А – одна из важнейших биоактивных молекул живой клетки – представляет собой модифицированный рибонуклеотид аденозин. К одному из остатков фосфорной кислоты присоединен "хвост", отдаленно напоминающий очень короткую белковую молекулу. Хвост заканчивается группой – SH, которая является активным центром молекулы. К этой сере может присоединяться ацетильная группа (-СО-СН3)у которая затем будет использована, например, для синтеза жирных кислот (ключевой этап синтеза липидов). Строение молекулы кофермента А заставляет задуматься о древнейших этапах эволюции жизни, когда рибонуклеотиды и простейшие белки (пептиды) еще только учились «жить и работать вместе»
Первые коацерваты могли образоваться самопроизвольно из липидов, синтезированных абиогенным путем. Впоследствии они могли вступить в симбиоз (взаимовыгодное сожительство) с "живыми растворами" – колониями самовоспроизводящихся молекул РНК, среди которых были и рибозимы, катализирующие синтез липидов. Подобное сообщество уже можно назвать организмом. У всех живых существ до сих пор в синтезе липидов важнейшую роль играет кофермент А, представляющий собой не что иное, как модифицированный рибонуклеотид. Это еще одно напоминание об РНК-мире.
Камнем преткновения для теории РНК-мира в течении некоторого времени была неспособность молекул РНК эффективно взаимодействовать с липидными мембранами. Недавно, однако, было показано, что комплексы из нескольких разных молекул РНК и ионов кальция способны не только прикрепляться к мембранам, но и регулировать их проницаемость.
РНК обзаводится помощниками
В дальнейшем РНК-организмы приобрели несколько важных усовершенствований. Самое главное из них состояло в том, что они научились синтезировать аминокислотные полимеры – сначала короткие пептиды, а затем и длинные белки. Эти вещества стали для РНК-организмов универсальными помощниками, справляющимися с большинством биологических "работ" гораздо лучше, чем рибозимы.
Откуда же взялась у РНК-организмов способность синтезировать белки? Чтобы ответить на этот вопрос, мы должны поближе познакомиться с рибосомами – сложными молекулярными "машинками", при помощи которых синтезируют белки все современные живые клетки.
Рибосомы у всех живых существ – от бактерий до человека – устроены очень похоже. По-видимому, это означает, что рибосомы в их "современном" виде имелись уже у общего предка всех нынешних форм жизни – у Луки, о котором говорилось в начале главы. Рибосома состоит из двух частей, или субъединиц, – большой (главной) и малой (вспомогательной). Основу обеих субъединиц составляют молекулы рибосомной РНК (рРНК). Снаружи к молекулам рРНК прилегают молекулы рибосомных белков. Поскольку рибосомы играют главную роль в синтезе белка (трансляции), вопрос о происхождении синтеза белка фактически сводится к вопросу о происхождении рибосом.
До самого недавнего времени многим экспертам казалось, что загадка происхождения рибосом вряд ли когда-нибудь будет разгадана. Ведь в природе не осталось никаких "переходных звеньев", то есть более простых молекулярных комплексов, которые могли бы претендовать на роль "предков" рибосом. Однако в начале 2009 года канадские биохимики, похоже, нашли ключик к этой тайне в самой структуре рибосом современных организмов[19].
Они сосредоточились на самой главной части рибосомы – на молекуле РНК, которая называется 23S-pPHK и является основой большой субъединицы рибосомы. Эта молекула весьма велика: она состоит почти из 3000 нуклеотидов. В клетке она сворачивается в сложный трехмерный "клубок". Разные петли, выступы и другие элементы структуры этого "клубка" обеспечивают выполнение разных функций: связь с рибосомными белками, присоединение малой субъединицы, присоединение и удерживание в нужных позициях молекул транспортных РНК (тРНК), которые несут на своих "хвостиках" аминокислоты, необходимые для синтеза белка.
Проведенные ранее эксперименты показали, что рибосомные белки играют в рибосоме вспомогательную роль: они делают ее более стабильной и повышают эффективность ее работы, однако все главные действия, необходимые для синтеза белка, осуществляются не белками, а рибосомными РНК. Это значит, что изначально рибосомы могли состоять только из рРНК, а белки добавились позже. Самый главный этап трансляции – присоединение аминокислот к синтезируемой белковой молекуле – осуществляется молекулой 23S-pPHK. Поэтому логично предположить, что все началось именно с этой молекулы.
Однако молекула 23S-pPHK слишком велика и сложна, чтобы появиться в готовом виде в результате случайного комбинирования нуклеотидов. Таким образом, ключевой допрос состоит в том, могла ли 23S-pPHK произойти от более простой молекулы-предшественницы в результате постепенной эволюции, то есть путем последовательного добавления новых фрагментов. Ученым удалось показать, что структура 23S-pPHK свидетельствует именно о таком ее происхождении.
Целостность трехмерной структуры молекулы 23S-pPHK поддерживается разнообразными связями между ее участками. Некоторые части молекулы сворачиваются в двойные спирали. К двойным спиралям "приклеиваются" другие участки молекулы, состоящие из нескольких идущих подряд аденозинов. Связи, возникающие между двойными спиралями и "стопками" аденозинов, необходимы для поддержания стабильной трехмерной структуры той части молекулы, к которой принадлежит аденозиновая "стопка", но они не влияют на стабильность той ее части, к которой принадлежит двойная спираль. Иными словами, если мы разорвем какую-нибудь из этих связей, это нарушит структуру той части молекулы, где находится аденозиновая "стопка", но не причинит вреда той части, где расположена двойная спираль. Таким образом, если 23S-pPHK развивалась постепенно из простой молекулы-предшественницы, то сначала должны были появляться двойные спирали, и только потом к ним могли "пристраиваться" аденозиновые стопки.
Изучая структуру 23S-pPHK, исследователи обратили внимание, что в одной части молекулы имеется скопление двойных спиралей и почти нет аденозиновых стопок. Это наблюдение навело ученых на мысль, что эволюция молекулы 23S-pPHK могла начаться именно с этого фрагмента молекулы.
Но если этот фрагмент был той "затравкой", с которой началась эволюция 23S-pPHK, то следует ожидать, что именно в нем находится какой-то важный функциональный центр молекулы. Так ли это? Оказывается, это действительно так: именно этот участок молекулы 23S-pPHK играет ключевую роль в присоединении аминокислот к синтезируемому белку. Он удерживает в правильных позициях "хвосты" двух молекул тРНК (той, что принесла предыдущую аминокислоту, уже присоединенную к белку, и той, что принесла следующую аминокислоту). Именно этот участок молекулы обеспечивает сближение новой аминокислоты с предыдущей, уже присоединенной к белку, и катализирует соединение аминокислоты с белком.
Обнаружив эти факты, исследователи перешли к более тонкому анализу структуры 23S-pPHK. Они подразделили молекулу на более тонкому анализу. Они подразделили молекулу на 60 относительно самостоятельных структурных блоков и детально проанализировали характер связей между ними. Фактически они рассматривали молекулу как сложный трехмерный "пазл" и пытались выяснить, поддается ли он сборке и разборке без поломки деталей. Оказалось, что молекулу действительно можно постепенно "разобрать", ни разу не нарушив структуру остающихся блоков. Сначала можно отделить 19 блоков, причем структура оставшихся блоков остается неповрежденной. После этого отделяются еще 11 блоков, затем еще 9, 5, 3, 3, 2, 2, 2; наконец, еще три блока можно отделить последовательно по одному. После этого остается "неразобранным" лишь маленький фрагмент молекулы, составляющий 7 % от ее общей массы. Этот неразобранный фрагмент представляет собой тот самый каталитический центр, ответственный за удерживание двух молекул тРНК и присоединение аминокислот к белку.
Возможность последовательной разборки молекулы без повреждения остающихся частей – факт весьма нетривиальный. Все блоки молекулы связаны друг с другом, причем связи эти имеют направленный характер: при их разрыве один блок повреждается, а другой – нет. Можно представить систему блоков и связей между ними как множество точек, соединенных стрелками, причем стрелка будет указывать на тот блок, который повреждается при разрыве связи. Если бы эти стрелки образовали хотя бы одну кольцевую структуру (иными словами, если бы мы, двигаясь из какой-то точки по стрелкам, могли вернуться в ту же точку), то разобрать молекулу без повреждения остающихся частей было бы невозможно. Однако ни одной такой кольцевой структуры в молекуле 23S-pPHK не обнаружилось. Если бы направление связей было случайным, вероятность отсутствия кольцевых структур составляла бы менее одной миллиардной. Значит, это вряд ли результат случайности. По-видимому, структура связей между блоками молекулы отражает последовательность добавления этих блоков в ходе постепенной эволюции молекулы.
Получается, что исходной функциональной молекулой – "проторибосомой", с которой началась эволюция рибосомы, – был каталитический центр молекулы 23S-pPHK, ответственный за соединение аминокислот.
Могла ли такая "проторибосома", способная удерживать две молекулы тРНК и сближать в пространстве прикрепленные к ним аминокислоты, выполнять какую-то полезную функцию в РНК-организме? Эксперименты позволяют ответить на этот вопрос утвердительно. Методом искусственной эволюции были получены функциональные РНК (рибозимы), способные катализировать соединение аминокислот, прикрепленных к тРНК, в короткие белковые молекулы. Структура этих искусственно выведенных рибозимов очень близка к структуре той проторибосомы, которую "вычислили" канадские биохимики на основе изучения структуры 23S-pPHK.
По-видимому, проторибосома была просто устроенным рибозимом, катализирующим синтез небольших белковых молекул в РНК-организме. Специфичность синтеза поначалу была очень низкой (аминокислоты выбирались более или менее случайно). В дальнейшем к проторибосоме добавлялись новые блоки, причем добавлялись они таким образом, чтобы не нарушить структуру активного центра молекулы, а также всех тех блоков, которые присоединились ранее. Если очередная мутация приводила к нарушению уже сложившихся структур, она отсеивалась отбором.
Ученые детально реконструировали предполагаемый процесс постепенной эволюции 23S-pPHK. Первые восемь дополнительных блоков присоединились к проторибосоме таким образом, что образовали нечто вроде массивного "основания", благодаря которому структура проторибосомы стала гораздо более стабильной. Следующие 12 блоков еще более укрепили и расширили это "основание". Новые блоки образовали поверхность контакта с малой субъединицей, что позволило включить ее в состав рибосомы. В числе последних добавились блоки, образующие особые выросты на поверхности большой субъединицы. Функция этих выростов состоит в том, что они помогают рибосоме выбирать "правильную" тРНК, несущую нужную аминокислоту, а также выпускать из рибосомы "отработанные" тРНК. В итоге проторибосома оказалась окружена другими блоками со всех сторон за исключением канала, который был оставлен для выхода образующейся белковой молекулы.
Таким образом, 23S-pPHK, при всей ее кажущейся сложности, построена на основе довольно простого принципа. Ее блочная структура свидетельствует о том, что она могла довольно быстро развиться в ходе эволюции из проторибосомы под действием мутаций и отбора.
ДНК и РНК – хранители наследственной информации. ДНК, как и РНК, формируются из кирпичиков – нуклеотидов, только чуть-чуть других. Чтобы из РНК-кирпичика (рибонуклеотида) сделать ДНК-кирпичик (дезоксирибонуклеотид), достаточно одной простой реакции – отнять у рибозы один из атомов кислорода. Это придает молекуле стабильность, а заодно лишает ее способности совершать активные действия.
Молекулы ДНК (как и РНК) способны к самокопированию, правда, для этого нужны катализаторы – белки или рибозимы. Наследственная информация, хранящаяся в ДНК в виде последовательности нуклеотидов, может "переписываться" на РНК (так создаются матричные РНК, мРНК) и обратно. Точность копирования обеспечивается в значительной мере автоматически – благодаря особому свойству нуклеотидов, которое называют свойством комплементарности: против каждого нуклеотида исходной молекулы (матрицы) в синтезируемой копии (реплике) может встать только один, строго определенный нуклеотид из четырех возможных. Напротив гуанина (Г всегда становится цитозин (Ц), напротив урацила (У) или замещающего его в молекуле ДНК тимина (Т) – только аденин (А). Когда на этой реплике синтезируется новая реплика, она окажется точной копией исходной молекулы.
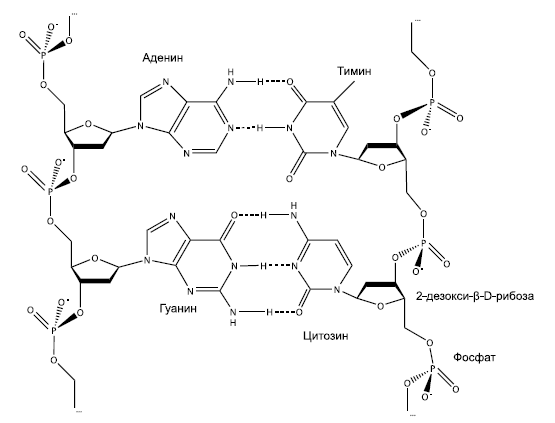
Фрагмент двойной цепи ДНК. По краям – "скелеты" одиночных цепей, составленные из остатков дезоксирибозы и фосфорной кислоты. В центре – две пары азотистых оснований, соединенных друг с другом по принципу комплементарности. Между аденином (А) и тимином (Т) образуются две водородные связи, между гуанином (Г) и цитозином (Ц) – три. Поэтому аденин может склеиться только с тимином, а гуанин – только с цитозином.
"Взаимовыгодное сотрудничество" РНК и белков (пептидов), вероятно, складывалось постепенно. Можно предположить, что изначально химические циклы с участием РНК и пептидов формировались порознь, возможно, в несколько разных условиях. Об этом свидетельствует химический состав этих веществ. В РНК много фосфора: остатки фосфорной кислоты вместе с остатками рибозы составляют "скелет" молекулы. Сера в состав РНК не входит. В белках, наоборот, нет фосфора, зато имеется сера, которая играет весьма важную роль в поддержании пространственной структуры белковой молекулы.
Поначалу синтез белков, осуществлявшийся РНК-организмами, скорее всего, не был строго специфичным: последовательности аминокислот из раза в раз воспроизводились не точно, а лишь приблизительно. Поскольку точность в данном случае резко повышала жизнеспособность организмов, естественный отбор способствовал выработке все более точных методов синтеза белка. Дело кончилось возникновением универсальной системы очень точного синтеза любого требуемого пептида. Это и был генетический код вкупе с рибосомами "современного" типа.
Генетический код – универсальный для всех живых существ способ, посредством которого первичная структура белковой молекулы (последовательность аминокислот) "кодируется" в молекуле ДНК (или РНК). Каждая аминокислота кодируется тремя нуклеотидами (кодоном, или триплетом). Нуклеотидов в ДНК всего 4, поэтому они могут образовывать 64 разных триплета. Аминокислот в белках всего 20, поэтому генетический код "избыточен": многие аминокислоты кодируются не одним, а несколькими взаимозаменимыми кодонами. Считывание генетической информации происходит в два этапа. Сначала информация "переписывается" с ДНК на РНК (транскрипция). Эту операцию осуществляет специальный фермент – ДНК-зависимая РНК-полимераза. Полученная в результате транскрипции молекула РНК, содержащая "инструкцию" по синтезу белка, называется матричной РНК (мРНК). Выполнение этой "инструкции", то есть синтез белка (трансляция), осуществляется рибосомами.
Вторым крупным усовершенствованием РНК-организмов было приобретение ДНК. Молекулы ДНК более устойчивы, чем РНК, и потому являются более надежными хранителями наследственной информации. Платой за стабильность стала неспособность молекул ДНК сворачиваться в сложные трехмерные структуры и выполнять какие-либо активные действия. Изначально ДНК, скорее всего, была чем-то вроде покоящейся фазы в жизненном цикле самовоспроизводящихся колоний РНК, и лишь много позднее она стала основным носителем наследственной информации.
Формы существования наследственной информации. Наследственная (генетическая) информация может существовать в двух формах – в виде ДНК и РНК. Копированием и переписыванием этой информации занимаются особые ферменты – НК-полимеразы. Существует четыре типа НК-полимераз:
1. ДНК-зависимые ДНК-полимеразы – осуществляют репликацию ДНК, то есть синтезируют ДНК на матрице ДНК. Эти ферменты просто копируют молекулы ДНК, как на ксероксе.
2. ДНК-зависимые РНК-полимеразы – осуществляют транскрипцию, то есть синтезируют РНК на матрице ДНК.
3. РНК-зависимые РНК-полимеразы – осуществляют репликацию РНК, то есть синтезируют РНК на матрице РНК.
4. РНК-зависимые ДНК-полимеразы (обратные транскриптазы, ревертазы) – осуществляют обратную транскрипцию, то есть синтезируют ДНК на матрице РНК.
Есть веские основания полагать, что первыми появились ферменты третьего типа, а от них потом произошли все остальные типы НК-полимераз.
Наследие РНК-мира
В последние годы одним из самых быстро развивающихся направлений в молекулярной биологии стало исследование разнообразных маленьких молекул РНК, которые, как выяснилось, играют огромную роль в жизни клетки. В результате этих исследований представления о молекулярных основах жизни сильно изменились. Еще лет 10–15 назад казалось, что РНК играет в клетке все-таки второстепенную роль. Сегодня стало ясно, что молекулы РНК являются активными участниками множества жизненно важных процессов. Постоянно открываются новые функциональные молекулы РНК и новые "роли", выполняемые этими молекулами в клетке. Эти открытия очень хорошо согласуются с теорией РНК-мира. Действительно, если древнейшие живые организмы умели обходиться вообще без белков и ДНК и все функции в них выполнялись молекулами РНК, то можно ожидать, что и в современных организмах эти многофункциональные молекулы не остались без работы (см. также главу "На подступах к неведомому").
Одним из явных отголосков эпохи РНК-мира являются недавно открытые удивительные структуры, получившие название РНК-переключателей.
РНК-переключатели впервые были обнаружены в 2002 году Рональдом Брейкером и его коллегами из Йельского университета. С тех пор число публикаций, посвященных этому странному и очень древнему механизму генной регуляции, стремительно растет.
Работа гена начинается с транскрипции – создания молекулы мРНК на матрице ДНК. Транскрибируется не только та часть ДНК, которая кодирует белок, но и кое-что "лишнее", в том числе участок перед началом кодирующей области. Здесь-то и располагаются РНК-переключатели. Они представляют собой последовательности нуклеотидов, которые сразу после транскрипции сворачиваются в замысловатые трехмерные структуры. Сворачивание осуществляется на основе принципа комплементарности (так же, как это происходит, например, с транспортными и рибосомными РНК). Самое важное, что область, где находятся РНК-переключатели, транскрибируется первой. РНК-переключатели приходят в рабочее состояние – то есть принимают нужную конфигурацию – сразу, как только их транскрибировали, и задолго до того, как закончится транскрипция всего гена. Это позволяет им прервать транскрипцию и тем самым фактически выключить ген.
РНК-переключатель состоит из двух функциональных частей. Первая часть представляет собой весьма избирательный и чувствительный рецептор, который способен связываться с одной строго определенной молекулой (например, с аминокислотой глицином или с S-аденозилметионином). Вторая часть устройства – это собственно переключатель. Когда рецептор связывается со "своей" молекулой, переключатель меняет свою пространственную конфигурацию, что и приводит к изменению активности гена. Например, переключатель может образовать "шпильку" – торчащий двухнитевой участок, который блокирует дальнейшую транскрипцию и на котором недоделанная информационная РНК просто-напросто обрывается.
Ключевой молекулой, которая приводит в действие РНК-переключатель, часто является вещество, производимое белком, ген которого этим переключателем регулируется. Например, если продуктом гена является белок, синтезирующий вещество А, то РНК-переключатель этого гена с большой вероятностью будет реагировать именно на вещество А. Таким образом формируется отрицательная обратная связь: когда какого-то продукта становится слишком много, производство белка, синтезирующего этот продукт, приостанавливается.
РНК-переключатели широко распространены во всех трех надцарствах живой природы – у бактерий, архей и эукариот. Наиболее разнообразны они у бактерий. Поскольку открыты они были всего несколько лет назад, неудивительно, что почти каждый месяц мы узнаем о них что-то новое. Сначала думали, что все РНК-переключатели снижают активность генов, но вскоре среди них были открыты и активаторы. Думали, что регуляторные контуры с участием РНК-переключателей всегда просты: один ген – один переключатель – одно сигнальное вещество. Однако в 2006 году в журнале Science появилась статья группы американских исследователей во главе с Брейкером, в которой описан новый тип регуляторного РНК-устройства, состоящего из двух разных РНК-переключателей[20]. Ученые установили, что комплекс из двух переключателей работает как логический элемент NOR (ИЛИ-НЕ). Иными словами, ген выключается, если оба или хотя бы один из двух переключателей свяжется со своей молекулой.
Открытие показало, что возможности безбелковой РНК-регуляции активности генов далеко не так ограниченны, как думали раньше. На основе простых РНК-переключателей могут создаваться более сложные регуляторные устройства, способные учитывать сразу несколько параметров окружающей среды.
Уже первооткрывателям РНК-переключателей сразу стало ясно, что они столкнулись с чем-то чрезвычайно древним.
Человек, обладающий хорошим воображением, может представить себе эту картину в красках – "считываемый" ген вдруг начинает шевелиться, воспринимать сигналы из окружающей среды, реагировать на них и вмешиваться в работу считывающего устройства: не читай меня больше! Таким образом, становится понятно, как далеки от истины были исходные представления об РНК как о безынициативном посреднике между ДНК и машиной синтеза белка.