
Александр Анатольевич Смирнов
Фармакология взаимодействия регуляторных пептидных систем головного мозга в механизмах подкрепления
Заинтересованность в GHS-R1A как в мишени для лечения появилась в 1980х годах, когда пептид, называвшийся пептид 6 релизинг-гормон роста (GHRP-6), каноничный представитель класса синтетических молекул, известных как секретируемый гормон роста (GHS), был определен как сильнейший стимулятор гипоталамо-гипофизарных осей роста (Bowers et al., 1984). Рецепторы к этим лигандам, GHR-R1A, были впервые описан несколько лет спустя группой MerckandCo (Howard et al., 1996).
Вскоре после исследования грелина, как первого эндогенного лиганда для GHS-R1A (Kojima et al., 1999), стало ясно что эти рецепторы также являются потенциальной цель для контроля за приемом пищи и ожирением. На грызунах инъекции грелина (периферически или центрально) вызывали быстрый орексиновый ответ (Asakawa et al., 2001; Wren et al., 2000). Также было найдено, что хроническая стимуляция рецепторов грелином (Tschop et al., 2000) или синтетически выращенными гормонами (Lall et al., 2001) повышала массу тела у грызунов. Уровни грелина повышаются перед приемом пищи (Cummings et al., 2001) и была показана корреляция со степенью голода у здоровых особей (Cummings et al., 2004) определяющяя то, что, по крайней мере в нормальной физиологии, острые изменения грелина, как изменяющегося гормона голода, могут участвовать в формировании решения к употреблению пищи.
В экспериментальных исследованиях на грызунах были определены возможные зоны действия грелина в ГМ: дугообразное ядро, вентромедиальное ядро, дорсомедиальное ядро, паравентрикулярное ядро, латеральный гипоталамус (Olszewski et al., 2003 a,b; Wren et al., 2001 a,b), ядра одиночного тракта ствола мозга (Faulconbridge et al., 2003), центральное ядро миндалины (Olszewski et al., 2003), вентральная область покрышки (VTA) и прилежащее ядро (Egecioglu et al., 2010; Naleid et al., 2005).
Изучая механизмы награды, как ключевые цели для грелина, становится ясно что центральная система грелина необходима для развития наркотической зависимости (Jerlhag et al., 2009; Kaurand, Ryabinin, 2010; Tessari et al.,2007; Wellman et al.,2005 ), а грелиновый рецептор, GHS-R1A, является важной терапевтической мишенью при аддиктивном поведении.
Мезолимбические дофаминовые пути из вентральной области покрышки в прилежащее ядро, которые играют важную роль в побудительной мотивации (желании) (Berridge and Robinson, 2003), являются важным компонентом грелин-опосредованной системы. Грелиновые рецепторы, представленные в вентральной области покрышки (Guan et al., 1997; Zigman et al., 2006), включают субпопуляцию дофаминовых клеток в этой области (Abizaid et al., 2006). Воздействие грелина на вентральную область покрышки активирует и повышает высвобождение дофамина, а также активирует локомоторную стимуляцию (Jerlhag et al., 2006a, 2007) и снижение захвата дофамина в N.Acc. (Abizaid et al., 2006). Периферически введенный грелин также стимулирует мезолимбическую дофаминовую систему (Jerlhag, 2008; Quartaetal., 2009).
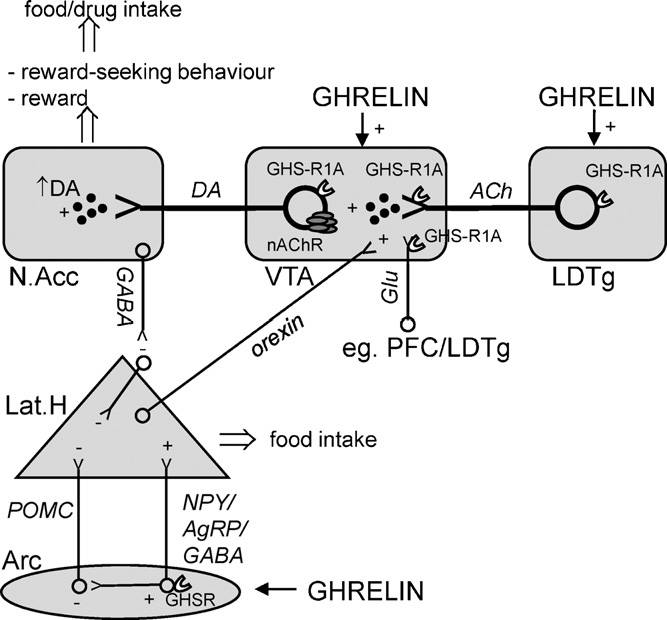
Схематичное изображение ключевых путей, через которые грелин регулирует пищевое поведение и поиск награды
Считается что грелин может иметь прямое влияние на узел подкрепления в LDTg (Guan et al., 1997) через GHS-R1A рецепторы, особенно выраженные на холинергических клетках (Dickson et all., 2010). Мы заметили, что локальное воздействие грелином в LDTg активирует показатели связанные с подкреплением, а именно локомоторную стимуляцию и высвобождение дофамина (Jerlhag et al., 2007). Более того, эти эффекты грелина были блокированы периферическим или интра-VTA воздействием неселективного холинергического никотинового антагониста, мекамиламином (Jerlhag et al., 2006a, 2008). К тому же, периферическая инъекция мекамиламина показала возможность блокирования грелина, локально воздействуя в VTA, чтобы повысить потребление пищи (Dickson et al., 2010). Совместно, эти исследования демонстрируют что грелин активирует холинергическо-дофаминергическую цепочку подкрепления, и таким образом может учавствовать в механизмах подкрепления.
В дальнейшем, с использованием селективного фармакологического антагониста субтипов никотиновых ацетилхолиновых рецепторов было показана способность грелина активировать холинергическо-дофаминергическую цепочку подкрепления опосредовано через особые субтипы никотиновых ацетилхолиновых рецепторов, а именно a3B2*, a6* и В3* (Jerlhag et al., 2008). Интересно, что эти субтипы также опосредуют подкрепляющие способности алкоголя и собственно потребление алкоголя грызунами (Ericson et al., 2009; Jerlhag et al., 2006b; Larsson and Engel, 2004; Lof et al., 2007; Steensland et al., 2007). Эти данные доказываются клиническими исследованиями; таким образом, блокируя эти субтипы рецепторов, возможно снижение употребляемой дозы (McKee et al., 2009).
Кроме того, было показано, что чрезмерное потребление алкоголя в длительный период времени, вызывает выброс ацетилхолина в VTA, следующий за повышением уровня прилежащего дофамина, доказывая, что алкоголь, как и грелин, активирует холинергическо-дофаминергическую цепочку подкрепления (Larsson et al., 2005). Анализирую полученные данные, возникают нейрохимические аналогии между грелином и алкоголем, где холинергическо-дофаминергическая цепочка подкрепления является главным регулятором.
Действие дофаминергических нейронов в VTA обеспечивается через различные афференты и, в пределах VTA, GHS-R1A представлены не только дофаминергическими клетками, но также пресинаптическими афферентами (Abizaid et al., 2006) которые могут обеспечивать способность грелина активировать систему награды. Особенно заметна возможность грелина повышать локомоторную активность, выброс прилежащего дофамина в условиях предпочтения места (совмесное воздействие подкрепления с грелин-парной средой), которая ослаблялась неселективными антагонистами глутамат NMDA рецепторов (AP5) (Jerlhag et al., 2011). Супрессия GHS-R1A уменьшает подкрепляющие свойства алкоголя и соответственно снижает потребление алкоголя у мышей (Jerlhag et al., 2009), а воздействие антагонистов GHS-R1A снижает подкрепляющие возможности амфетамина и кокаина (Jerlhag et al., 2010). Клинические данные также говорят о роли GHS-R1A в регуляции потребления наркотиков (Landgren et al., 2008, 2010). Интересен тот факт, что ограничение пищи, которое повышает уровень грелина (Gualillo et al., 2002), увеличивает кокаино- и амфетаминоиндуцированную локомоторную стимуляцию, увеличивает поиск кокаина и самостимуляцию от какоина или амфетамина у крыс (Carroll et al., 1979).
В исследованиях человеческого генома гиплотип грелинового гена был связан с отцовским наследованием расстройств употребления алкоголя (Landgren et al., 2010) и с повышением степени алкогольной зависимости (Landgren et al., 2008).
После употребления алкоголя уровень грелина в плазме снижается у здоровых особей (Calissendorff et al., 2005, 2006; Zimmermann et al., 2007) в одинаковой степени как и после приема пищи (Tschop et al., 2001). Было показано, что повышение уровня грелина во время первоначальной фазы абстиненции, не отличается от здоровой группы поздних фаз абстиненции (Wurst et al., 2007), и что повышение уровня грелина связано с непреодолимым желанием во время абстиненции (Addolorato et al., 2006).
Таким образом, точный механизм, через который грелин вызывает потребление и поиск награды достаточно хорошо изучен, но вероятно включает работу на уровне холинергическо-дофаминергической системы подкрепления. GHS-R1A представлены пре- и постсинаптически в VTA (Abizaid et al., 2006), а также на холинергических нейронах в LDTg (Dickson et al., 2010). Грелиновые инъекции в эти области мозга повышают прилежащий дофамин (Jerlhag et al., 2007), повышают потребление алкоголя (Jerlhag et al., 2009) и потребление пищи совместно с мотивированными поведениями, связанными с предпочитаемой пищей (Egecioglu et al., 2010; Skibicka et al., inpress-b). Центральная грелиновая сигнальная система изменяет некоторые компоненты дофаминергических нейронов в VTA и повышает возможность подкрепляющих агентов, таких как пища, алкоголь или наркотические вещества, активируя среднемозговую дофаминовую систему подкрепления (Holst et al., 2003). Возможно GHS-R1A регулируются независимо от грелина, например, через гетеродимеризацию на дофаминовые D1-рецепторы (Jiang et al., 2006).
Центральная грелиновая система показала значение в подкреплении от алкоголя (Jerlhagetal.,2009, inpress), кокаина, амфетамина (Jerlhag et al., 2010; Wellman et al., 2005; Tessari et al., 2007), и предпочитаемой пищи (Erecioglu et al., 2010; Perello et al., 2010; Skibicka et al., inpress-a, inpress-b). Совместно эти данные подразумевают, что грелиновая центральная система, включая GHS-R1A, может являться ведущей целью для развития стратегии лечения наркотической зависимости.
1.5. Кортиколибериновая система мозга
В 1950-х гг. в гипоталамусе обнаружили фактор пептидной природы, активирующий гипоталамо-гипофизарно-надпочечниковую систему (ГГНС). И только в 1981 г. этот фактор – КРГ – выделили из гипоталамуса овцы (Vale et al., 1981). Доказали, что КРГ является пептидом, состоящим из 41 аминокислотного остатка, и синтезируется в парвоцеллюлярных нейронах гипоталамуса (Vale et al., 1981; Swanson et al., 1983). Под влиянием стрессорных стимулов КРГ транспортируется посредством аксонального транспорта из гипоталамуса в срединное возвышение. Затем он высвобождается в систему портальной циркуляции и активирует высвобождение дериватов проопиомеланокортина (таких как АКТГ и β-эндорфин) из передней доли гипофиза. АКТГ попадает в общую систему кровообращения, достигает надпочечников и активирует высвобождение глюкокортикоидов. КРГ-иммунореактивные клетки обнаружили не только в паравентрикулярном ядре гипоталамуса, но и экстрагипоталамически. КРГ-иммунореактивные клетки широко представлены в центральном ядре миндалины, ядре ложа конечной полоски, голубом пятне (locuscoeruleus), парабрахиальных ядрах, дорсальном комплексе блуждающего нерва, префронтальной коре (Swanson et al., 1983). Анатомическое распределение КРГ говорит об участии этого нейропептида в регуляции реакций на стрессорные раздражители, вегетативной нервной системы, потребления пищи и когнитивных процессов. Позже, фармакологическими исследованиями (Nijsen et al., 2000; vanGaalen et al., 2003; Zorrilla et al., 2003) подтвердилось решающее значение КРГ в контроле этих физиологических процессов. Участие КРГ в регуляции стрессорных реакций подтверждается данными об увеличении содержания пептида в реакции на стресс в различных областях мозга, включая медиабазальные отделы гипоталамуса и центральное ядро миндалины (MerloPich et al., 1993; Merali et al., 1998; Hand et al., 2002; Cook, 2004). Было показано, что длительный стресс ускоряет адаптацию гипоталамической и экстрагипоталамической КРГ-систем, что меняет поведенческие и физиологические ответы на стресс (Albeck et al., 1997; Breese et al., 2004; Bruijnzeel et al., 2001, 2005).
Вскоре после биохимических исследований пептидов семейства КРГ авторадиографически охарактеризовали участки связывания КРГ и КРГ-подобных пептидов. Максимальная плотность данных участков связывания зарегистрирована в передней доле гипофиза, миндалине, коре мозга и гиппокампе (DeSouza et al., 1984, 1985). Примерно через 10 лет после этого клонировали два типа рецепторов к КРГ – КРГ1 и КРГ2 рецепторы (Chen et al., 1993; Perrin et al., 1993; Lovenberg et al., 1995). Два подтипа рецепторов КРГ являются рецепторами, связанными с G-белком и аденилатциклазой (Chalmers et al., 1996; Lewis et al., 2001). КРГ1 рецептор экспрессируется в передней доле гипофиза и играет более значимую роль, чем КРГ2 рецептор, в регуляции гипоталамо-гипофизарно-надпочечниковой системы (Chalmers et al., 1995; Potter et al., 1994). Более того, КРГ1 рецептор экспрессируется в неокортикальных областях, мозжечке, гиппокампе, базолатеральной миндалине и структурах ствола мозга, таких как заднее-боковое и педункуло-мостовое ядра покрышки и парабрахиальное ядро (Potter et al., 1994). КРГ2 рецептор существует в трех изоформах: КРГ2a и КРГ2b рецепторы найдены у крыс и человека, а КРГ2c рецепторы – только у человека (Lovenberg et al., 1995; Liaw et al., 1996; Kostich et al., 1998). В противоположность КРГ1 рецепторам КРГ2a рецепторы экспрессируются преимущественно в подкорковых структурах мозга: боковая перегородка, паравентрикулярное и вентромедиальное ядра гипоталамуса (Lovenberg et al., 1995). КРГ2b рецептор экспрессируется в ненейрональных структурах на периферии и в меньшей степени в мозгу (Lovenberg et al., 1995).
Внутрижелудочковое введение КРГ инициирует широкий спектр физиологических и фармакологических реакций. Поведенческие эффекты КРГ зависят от состояния животного. Например, центрально вводимый КРГ вызывает поведенческую активацию у грызунов, находящихся в их обычных условиях (Sutton et al., 1982; Dunn, Berridge, 1990). При этом, КРГ вызывает выраженное угнетение поведения у животных, подвергнутых значимому стрессорному воздействию (Cole, Koob, 1988). Повышенная тревожность крыс после центрального введения КРГ показана в разных экспериментальных тестах. КРГ при центральном введении удлиняет латентный период выхода и снижает время нахождения вне темной камеры в оборонительном тесте (Takahashi et al., 1989), снижает время нахождения в открытых рукавах приподнятого крестообразного лабиринта (Moreau et al., 1997), снижает общительность в зоосоциальных тестах (Dunn, File, 1987), потенцирует звуковую мигательный реакцию (стартл-рефлекс) (Swerdlow et al., 1986).
Исследования с использованием антагонистов рецепторов КРГ, подтвердили мнение, что КРГ вызывает тревожность и депрессивноподобное состояние. Блокирование рецепторов КРГ не влияет на поведение при условиях воздействия слабых стрессорных факторов. Наоборот, антагонисты рецепторов КРГ снижают тревожность у предварительно стрессированных крыс или у животных, тестированных в условиях воздействия похожих аверсивных стрессорных факторов (Menzaghi et al., 1994). Последующие исследования в этом направлении делались с использованием антагонистов КРГ1 рецепторов, которые, как оказалось, обладают анксиолитическими свойствами. Было доказано, что большинство селективных антагонистов рецепторов КРГ1 снижают тревожность в разных экспериментальных моделях на животных (Okuyama et al., 1999; Keck et al., 2001; Griebel et al., 1998, 2002; Li et al., 2003; Lelas et al., 2004). Важно озаметить, что многие антагонисты КРГ1 рецепторов вместе с анксиолитической обладают и антидепрессантной активностью (Cryan et al., 2002; Griebel et al., 2002).
Интересно, что острая отмена алкоголя приводит к инициации центральных механизмов стресса, в частности, системы кортиколиберина, с которыми во многом связывают негативную эмоциональную настроенность пациента (Weiss et al., 2001; Koob, 1999, 2003). В результате этой активации повышается вероятность развития достаточно тяжелых эмоциональных расстройств (тревожное и депрессивное состояния) (Nemeroff, 1992; Adamec, 1997; Stam, 2000). Кроме активации системы КРГ алкоголь повышает высвобождение адренокортикотропного гормона (АКТГ) и глюкокортикоидов посредством активации рецепторов КРГ в мозгу (Wilkins et al., 1982; Seyler et al., 1984; Sarnyai et al., 2001). Активация гипоталамо-гипофизарно-надпочечниковой системы потенцирует подкрепляющие эффекты психоактивных веществ, облегчая мозговую самостимуляцию и самовведение этих субстанций (Piazza, LeMoal, 1998; Лебедев А.А., 2002; Goeders, 2003; Мещеров Ш.К., 2004; Шабанов П.Д. и др., 2002, 2004, 2006). Более того, стрессогенные факторы сенситизируют экстрагипоталамическую КРГ-систему, которая сама по себе потенцирует подкрепляющие эффекты психоактивных веществ (Cole et al., 1990; Cador et al., 1993; Stam et al., 2000; Bruijnzeel et al., 2001). Исходя из этого, изучение значения центральных механизмов стресса для развития алкогольной зависимости представляется крайне важным.
Таким образом, мы имеем прямые доказательства участия рецепторов КРГ и всей кортиколибериновой системы в механизмах аддикции, вызываемых психостимуляторами, опиатами, гипноседативными средствами и гваллюциногенами (Sarnyai et al., 2001; Koob, 2003; Bruijnzeel, Gold, 2005).
1.6. Заключение
Данный обзор показывает, что структуры центральной расширенной миндалины формируют важнейшую часть системы, обеспечивающей воспроизведение и поддержание подкрепляющих свойств самостимуляции медиального переднемозгового пучка. Она взаимодействует с миндалиной, вентральным стриопаллидумом и магноцеллюлярным комплексом, осуществляя функциональные связи для обеспечения деятельности системы награды, а также связи с корковыми зонами мозга, участвующими в подкреплении.
К числу значимых элементов подкрепления следует отнести кортиколибериновую систему мозга. Приведенные в обзоре данные указывают на вероятное участие рецепторов КРГ в механизмах тревоги и депрессии, которые, как правило, сопровождают течение лекарственной зависимости и являются неотъемлемыми элементами данного заболевания. Кроме того, имеются прямые доказательства участия рецепторов КРГ и всей кортиколибериновой системы в механизмах аддикции, вызываемых психостимуляторами, опиатами, гипноседативными средствами и гваллюциногенами [Sarnyaietal., 2001; Koob, 2003; Bruijnzeel, Gold, 2005].
Неоспорима существенная роль орексиновой и грелиновой системы в механизмах подкрепления. В обзоре обозначены вероятные механизмы работы этих систем, зоны влияния и точки приложения.
Роль каждой из этих систем к настоящему времени становится вполне понятна, однако, если рассматривать ситуацию вцелом, возникает вопрос взаимодействия их между собой. Или же это независимые друг от друга рычаги влияния на процесс развития аддикции? Ответив на эти вопросы мы сможем еще на один шаг приблизиться к пониманию механизмов возникновения зависимости, а значит, к способам воздействия на этот процесс. Именно эти данные и позволили сформулировать цель настоящего исследования.
Глава 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Выбор животных
Опыты выполнены на крысах самцах Вистар массой 200-220 г, выращенных в группе по 5 особей в стандартных пластмассовых клетках в условиях вивария кафедры фармакологии Военно-медицинской академии им. С. М. Кирова. Температура воздуха поддерживалась в пределах 20-22°C, относительная влажность – 50–70%. Животных содержали при свободном доступе к воде и пище в условиях инвертированного света 8.00-20.00. Все опыты проведены в осенне-зимний период.
2.2. Вживление электродов и канюль в структуры мозга
Вживление электродов и канюль в мозг крысам проводили под нембуталовым наркозом (50 мг/кг) с использованием стереотаксического прибора фирмы «Medicor», Венгрия. Билатерально в латеральное гипоталамическое ядро вживляли нихромовые монополярные электроды в стеклянной изоляции (диаметр электрода 0,25 мм, длина оголенного кончика 0,25-0,30 мм, его толщина 0,12 мм) по следующим координатам: АР = 2,5 мм назад от брегмы, SD = 2,0 мм латерально от сагиттального шва, Н = 8,4 мм от поверхности черепа (KönigK. P., KlippelA. A., 1963; Дробленков А. В., 2006). Индифферентный электрод из нихромовой проволоки закрепляли на черепе животного. Все электроды коммутировались на микроразъеме, который фиксировался на черепе самотвердеющей пластмассой (рис.1).




Рис. 1. Последовательные этапы проведения операции по вживлению
электродов и микроканюль в мозг крысы
Металлические направляющие канюли из нержавеющей стали диаметром 0,2 мм вживляли униполярно в правый желудочек мозга одновременно с электродами, вводимыми в латеральный гипоталамус, по следующим координатам (рис.2): АР = 0,8 мм назад от брегмы, SD = 1,4 мм латерально от сагитального шва, Н = 3,8 мм от поверхности черепа согласно атласу K. P. König и A. A. Klippel (1963).

А

Б
Рис. 2. Морфологическая картина зон микроинъекций веществ в центральное ядро миндалины (А) и ядро ложа конечной полоски (Б)
Координаты по атласу К. Кёнига и А. Клиппеля (1963). Показаны фронтальные срезы в мм относительно брегмы.
Канюли фиксировали на черепе животного самотвердеющей пластмассой и после операции закрывали специальным колпачком, который временно снимали для введения веществ в структуру мозга.
При внутриструктурном введении веществ в направляющие вставляли металлические микроканюли диаметром 100 мкм, кончик которых был на 0,2 мм длиннее направляющей.
Поведенческие эксперименты начинали не ранее 10 дней после операции. По окончании всех опытов производили морфологический контроль локализации кончиков электродов на серии фронтальных срезов мозга, которые окрашивали по методу Ниссля, предварительно производили коагуляцию через вживленные электроды током силой 1 мА в течение 30 с. (рис.4).

Рис. 4. Фронтальный срез головного мозга крысы.
Стрелкой указана область вживления электрода в латеральный гипоталамус.
2.3. Методы самораздражения мозга у крыс
Для воспроизведения самораздражения мозга у крыс использовали классический вариант изучения самостимуляции мозга в виде педальной самостимуляции в камере Скиннера. Через 10 дней после вживления электродов в мозг крыс обучали нажимать на педаль в камере Скиннера для получения электрического раздражения мозга (прямоугольные импульсы отрицательной полярности, длительностью 1 мс, с частотой 100 Гц, в течение 0,4 с, пороговыми значениями тока в режиме «фиксированных пачек»– FR1). Для повторного раздражения животное было вынуждено вновь нажимать на педаль. Анализировали частоту и пороги реакции самостимуляции. Фармакологические препараты вводили на 3-й день эксперимента после стабилизации реакции при использовании фиксированного значения силы тока. Частота нажатий регистрировалась автоматически (рис.5).



Рис. 5. Реакция педальной самостимуляции у крыс в камере Скиннера
Два верхних фото демонстрируют нативную методику самостимуляции,
внизу – схематическое изображение методики.
Регистрировали число нажатий на педаль в течение 10 мин эксперимента, затем производили внутриструктурную микроинъекцию препарата и через 15-20 мин повторно регистрировали число нажатий на педаль за 10-минутный интервал времени. В дополнительных сериях экспериментов исследовали порог возникновения реакций нажатия на педаль. После определения значений силы тока, когда наблюдаются первые изменения в поведении животного, производили ступенчатое повышение тока с шагом в 5 мкА. В камере Скиннера подавали ток в навязанном режиме (серии прямоугольных импульсов отрицательной полярности, длительностью 1 мс, с частотой 100 Гц, в течение 0,4 с, интервалы между сериями импульсов 0,5 с) нарастающими порциями (primingstimulation) с интервалом 30 с длительностью по 5 с до появления стойких нажатий педали. Процедуру поиска пороговых значений силы тока повторяли 2 раза. Затем повышали силу тока на 10% от пороговых значений, когда наблюдали выраженную реакцию самостимуляции, и снижали ток порциями (шаг 5 мкА длительностью 30 с) до появления отказа от нажатий педали. Процедуру поиска пороговых значений силы тока также повторяли 2 раза. При совпадении значений силы тока, полученных с использованием нарастающего и снижающего режимов, его считали порогом реакции самостимуляции. Затем производили внутриструктурную микроинъекцию препарата, и через 15-20 мин повторно производили поиск порога реакции самостимуляции.
При изучении подкрепляющих свойств электрической стимуляции мозга в ряде случаев использовался свободный режим подкрепления, когда электрическая стимуляция мозга длится все время нажатия педали (Лебедев А. А., Шабанов П. Д., 1992). Использование данного режима предполагает повышенный уровень нагрузки на подкрепляющие механизмы головного мозга и дает возможность выявлять отрицательную эмоциональную составляющую реакции самостимуляции, которая обычно следует после 0,5 секунды начала раздражения и заставляет животное отжимать педаль, как бы избегать ее (Звартау Э. Э., 1988; Вартанян Г. А., Петров Е. С., 1989).
2.4. Условное предпочтение места
Опыты с условной реакцией предпочтения места проводили в прямоугольной двухкамерной экспериментальной установке размером 35*35*30 см, стороны которой различались цветом (темный и светлый) и текстурой пола и были разделены перегородкой с опускающейся и поднимающейся дверцей. В течение первых двух дней эксперимента животных помещали в установку с целью их адаптации. В первый тестовый день регистрировали время нахождения животного в каждом отсеке в течение 10 мин для определения исходного предпочтения. Отсек считался предпочитаемым, если животное проводило в нем больше 50% времени. В последующие 6 дней обусловливания дверцу между отсеками закрывали. В традиционном варианте животные получают через день инъекцию препарата непосредственно перед помещением в исходно непредпочитаемый отсек на 60 мин и инъекцию физиологического раствора перед помещением в исходно предпочитаемый отсек; животные контрольной группы получают только физиологический раствор. В условиях наших опытов в качестве средства инициации предпочтения использовали грелин (или орексин), вводимый внутрижелудочково. Во второй тестовый день дверцы открывали и повторно измеряли время нахождения в каждом из отсеков в течение 10 мин. Животные контрольной группы получали только физиологический раствор.
2.4.1. Методика выработки условного предпочтения места
Животному делается укол без введения каких-либо веществ, затем через 5 минут оно помещается в предпочитаемое поле на 30 мин. После часа перерыва тому же животному вводится препарат, вызывающий предпочтение места совместно с исследуемым веществом, и через 5 минут оно помещается в непредпочитаемое поле камеры на 30 минут. Таким образом втечение пяти дней подряд мы проводим группу животных, пытаясь вызвать у них стойкое предпочтение, ранее непредпочитаемого поля. На шестой день мы сажаем то же животное (уже не вводим никаких препаратов) в камеру с открытой дверцей между полями на 10 мин. Далее определяем время нахождения животного в каждом отсеке и число переходов между ними. Результаты считаются положительными, если на шестой (контрольный) день у животного не выработалось предпочтение места.
2.4.2. Методика экспрессии выработанного предпочтения места
Животному делается укол без введения каких-либо веществ, затем через 5 минут оно помещается в предпочитаемое поле на 30 мин. После часа перерыва тому же животному вводится препарат, вызывающий предпочтение места, и через 5 минут оно помещается в непредпочитаемое поле камеры на 30 минут. Таким образом втечение пяти дней подряд мы проводим группу животных, вызывая у них стойкое предпочтение, ранее непредпочитаемого поля. На шестой день мы помещаем животное в камеру с открытой дверцей между полями, не вводя при этом никаких препаратов. При правильном выполнении методики мы получаем предпочтение животными ранее непредпочитаемого поля. На седьмой день мы НЕ вводим препарат, вызывающий предпочтение места, а используем исследуемое вещество, вероятно блокирующее выработанное, в ходе методики, предпочтение. Поднимаем дверцу между полями и сажаем животное в камеру на 10 мин. Далее определяем время нахождения в каждой камере и число перебегов между ними. Результаты считаются положительными если время нахождения в отсеке с введением препарата, вызывавшего предпочтение места, снижается после введения исследуемого вещества (относительно контрольной группы без введения интересующего нас препарата).
2.4.3. Влияние типа покрытия поля на эффект фенамина
Препарат
Колличество времини в другом поле (с.)
Колличество времини в поле, в котором вводились препараты (с.)
Колличество перебегов между полями (среднее)
Фенамин 1мг/кг, в/б на поле с решеткой
175,4 ± 44
424,6±44*
7±2
Фенамин 1мг/кг, в/б на гладком поле
183±45
417±46*
7,5±3
Вывод: в ходе эксперимента мы выяснили, что тип покрытия отсека в опыте с предпочтением места не влияет на эффект фенамина и в анализе следующих данных учитываться не будет.
2.5.Фармакологические вещества, используемые для анализа
эмоциональных форм поведения
Для фармакологического анализа использовали психомоторный стимулятор фенамин (1 мг/кг), который вводили внутрибрюшинно за 30 мин до изучения самостимуляции (после определения фоновых ее значений), а в опытах условного предпочтения места непосредственно перед помещением в исходно непредпочитаемый отсек. Астрессин (неизбиральный антагонист рецепторов КРГ), грелин, орексин, а также их антагонисты: синтетический антагонист OX1R рецепторов орексина – SB-408124, рекомбинантный антагонист OX1R рецепторов – Orexin B18-28, пептидный антагонист грелина – [D-Lys3]-GHRP-6. Все препараты в трех дозировках по 0,1; 1; 10 мкг (Sigma, США) вводили внутриструктурно в желудочек мозга через вживленную канюлю. Субстанции веществ растворяли в дистиллированной воде и вводили в объеме 1 мкл с помощью микроинъектора СМА-100 (Швеция) в течение 30 с за 10-15 мин до тестирования после определения исходных значений самораздражения латерального гипоталамуса.
2.6. Статистическая обработка полученных материалов
Выборка для каждого вещества составила не менее 10-12 опытов. Для статистической обработки полученных количественных данных и построения графиков применяли пакеты программ GraphPadPrizmv.5, SPSSSigmaStat 3.0 и Minitab 14. Для оценки соответствия распределений случайных величин гауссовым применяли критерий нормальности Колмогорова–Смирнова. Для сравнения контрольной и экспериментальных групп использовали непараметрический критерий Вилкоксона для парных сравнений.


