
Я. Л. Мархоцкий
Радиационная и экологическая безопасность атомной энергетики
Рецензенты: заведующий кафедрой «Основы медицинских знаний» Белорусского государственного педагогического университета имени М. Танка, доктор медицинских наук, профессор В.П. Сытый; главный научный сотрудник Управления системной интеграции, академик Международной академии наук информации, информационных процессов и технологии при ООН, доктор технических наук, профессор В.О. Чернышев
Выпуск издания осуществлен по заказу и при финансовой поддержке Министерства информации Республики Беларусь.
Предисловие
В настоящее время атом – это не только ядерное оружие различных видов, но и работающий энергоблок на АЭС, атомные ледоколы, мощные подводные лодки, надводные корабли, спутники, аппараты для лучевой терапии, радиационные дефектоскопы, электрокардиостимуляторы. Конечно, это неполный перечень использования источников ионизирующей радиации.
Атомная энергетика – молодая отрасль науки и техники. По мнению ученых, она в недалеком будущем станет основным поставщиком энергии, в том числе и электрической.
Атомная энергетика во многих странах выросла, возмужала и вышла на широкую дорогу промышленного производства электрической энергии, например в США, Англии, Франции, Канаде, Италии, Германии, Японии, Литве. В мире насчитывается 442 ядерных реактора общей мощностью свыше 365 тыс. МВт. Они расположены более чем в 30 странах. Строятся десятки новых реакторов. По данным МАГАТЭ, более 18 % электроэнергии, вырабатываемой в мире, производится на ядерных реакторах. Такие государства как Литва (80,6 %), Франция (77 %), Словакия (57,8 %) большую часть своих потребностей в электроэнергии удовлетворяют за счет АЭС.
К настоящему времени атомная энергетика смогла продемонстрировать свою жизнеспособность, экологическую привлекательность и возможность безопасного и конкурентоспособного обеспечения энергопотребностей общества.
Беларусь относится к категории стран, не обладающих значительными собственными топливно-энергетическими ресурсами, но это не препятствие для достижения высокого уровня экономического развития. Строительство собственной АЭС позволит снизить зависимость от импорта энергоресурсов и обеспечит республику относительно дешевой электроэнергией.
Автор
Элементы ядерной физики
Краткая история создания атомистического учения
Создание атомистической теории обычно приписывают древнегреческому философу Демокриту, жившему в Y в. до н. э.
Однако историки утверждают, что основателем теории является учитель Демокрита – Левкипп, который считал, что материя состоит из отдельных непрерывно движущихся частиц (атомов). Древние атомисты Греции, Китая, Индии провозгласили, хотя и в самой общей форме, основное положение материалистической философии: материя несотворима, неуничтожима, вечна и бесконечна. Гениальную идею древних подтвердил М.В. Ломоносов в 40-х гг. XVIII в., разработав атомно-молекулярную теорию строения вещества. Согласно этой теории, вещество состоит из «корпускул» (молекул), которые, в свою очередь, состоят из элементов (или «нечувствительных физических частичек» – атомов). М.В. Ломоносов утверждал, что все движения материи сводятся к движению атомов и являются причиной всех изменений в природе. Он заложил основу дальнейшего познания тайн атомов, т. е. начался период химической атомистики.
В феврале 1896 г. французский ученый А. Беккерель обнаружил, что соли оксида урана засвечивают фотографическую пластинку, завернутую в светонепроницаемую бумагу. Таким образом было открыто неизученное ранее явление природы – испускание ураном неизвестного проникающего излучения, названного радиоактивностью. Исследования Беккереля были продолжены М. Склодовской-Кюри и П. Кюри, которые открыли радиоактивные элементы: торий, полоний, радий, актиний. Беккерелю и супругам Кюри за исследования радиоактивности в 1903 г. была присуждена Нобелевская премия по физике.
Строение атома и атомного ядра
Природа состоит из простых и сложных веществ. К простым веществам относятся химические элементы, к сложным – их химические соединения. Мельчайшей частицей элемента, обладающей его химическими свойствами, является атом.
Спустя год после открытия радиоактивности английский физик Дж. Томсон установил, что элементарная частица – электрон — действительно существует и является составной частью вещества. Теория же атомного ядра появилась через 15 лет благодаря последователям английского ученого Э. Резерфорда и работам знаменитого датского физика Н. Бора.
В 1913 г. Н. Бор предложил модель атома, за основу которой была принята планетарная модель Э. Резерфорда. Согласно ей, атом состоит из положительно заряженного, расположенного в центре, ядра, вокруг которого движутся по своим строго определенным орбитам отрицательно заряженные частицы – электроны, точно так же, как планеты вокруг Солнца (рис. 1).
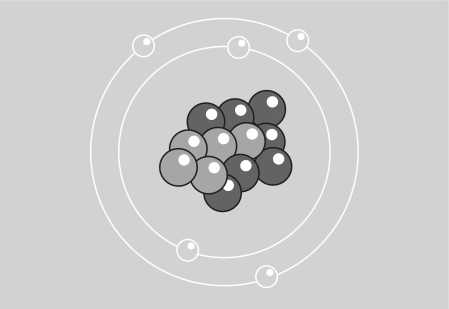
Рис. 1. Схема планетарного строения атома
Эти «летающие планеты» образуют вокруг ядра электронную оболочку. Электроны находятся на различных расстояниях от него. Их количество в атоме таково, что общий заряд нейтрализует положительный заряд ядра. Потеря электрона приводит к ионизации атома.
Кроме электронов, атомы содержат протоны и нейтроны в ядре атома. Протоны имеют положительный заряд. В связи с этим у нейтрального атома равное количество электронов и протонов. Количество протонов в ядре равно порядковому номеру элемента в Периодической системе элементов Д.И. Менделеева.
В отличие от протонов нейтроны не обладают электрическим зарядом. В современной физике протоны и нейтроны объединяют общим названием нуклон (от лат. nucleus – ядро). Общее число нуклонов в атомном ядре соответствует массе атома. Обычно массу атомов всех химических элементов выражают в относительных единицах, условно приняв за единицу 1/12 часть массы основного изотопа углерода С12.
Диаметр атома приблизительно равен 10-10 м, а его ядро имеет очень малые размеры – 10-15 – 10-14 м. Принадлежность атома данному элементу обусловлена количеством протонов в ядре. На рис. 2 представлены схематичные модели некоторых атомов.
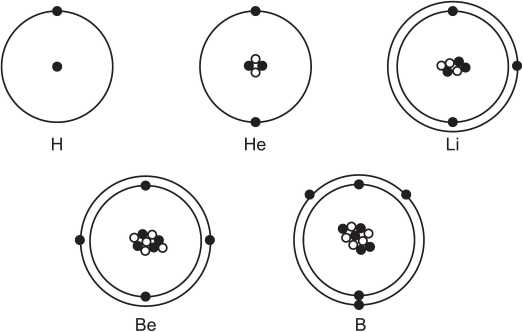
Рис. 2. Схематичные модели атомов водорода, гелия, лития, бериллия, бора
В центре расположено ядро, состоящее из протонов (черные кружки) и нейтронов (белые кружки). Вокруг ядер вращаются электроны. Число протонов в ядрах определяет, какой это элемент.
Изотопы
Изотопы – это разновидности одного и того же химического элемента. Их название (от греч. isos — одинаковый и topos – место) в дословном переводе означает «из одного места», иными словами – вещества, занимающие одно место в Периодической системе элементов Д.И. Менделеева.
Атомы как материальные частицы обладают микроскопической массой. Поэтому физики выражают массу атомов не в единицах массы, а в числах протонов и нейтронов, составляющих ядро данного атома, и называют массовым числом.
Атомы, имеющие ядра с одинаковым числом протонов, но различающихся по числу нейтронов, являются разновидностями одно и того же химического элемента и называются его изотопами. На рис. 3 представлены изотопы водорода.
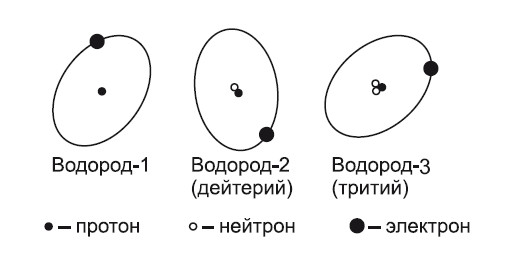
Рис. 3. Изотопы водорода
В ядре его атома либо вообще нет нейтронов, либо есть один или два. Это значит, что водород существует в виде трех изотопов, т. е. в виде трех атомов различной массы, но с одинаковым зарядом ядра. Следовательно, для того чтобы различать изотопы, их обозначают числом, равным сумме входящих в ядро протонов и нейтронов. Для водорода это соответственно водород-1 (обычный), водород-2 (дейтерий), водород-3 (тритий). В ядре цезия-137 содержится 55 протонов и 82 нейтрона (Cs15357), в радии-226 содержится 88 протонов и 138 нейтронов (Ra28286). Оказалось, что 106 элементов имеют 1600 разновидностей. Из этого числа около 365 изотопов существуют в природе, а свыше 1250 получены искусственно.
Ядра изотопов химических элементов называют нуклидами. Радионуклиды – это радиоактивные атомы с данным массовым числом и атомным номером. Большинство нуклидов нестабильно, они превращаются в другие нуклиды.
Радиоактивность
Радиоактивность – это самопроизвольное превращение (распад) атомных ядер некоторых химических элементов, приводящее к изменению их атомного номера и массового числа. Распад радиоактивных ядер сопровождается ионизирующим излучением и высокой энергией.
Ионизирующие излучения получили свое название благодаря способности вызывать ионизацию атомов и молекул в облучаемом веществе. Ионизирующие излучения подразделяются по своей природе на электромагнитные и корпускулярные.
Электромагнитное излучение – это рентгеновское излучение, γ-излучение радиоактивных элементов и тормозное излучение, возникающее при прохождении частиц. Видимый свет и радиоволны относятся также к электромагнитным излучениям. Однако они ионизирующей способностью не обладают, так как характеризуются большой длиной волны.
Корпускулярные излучения – это все остальные виды ионизирующих излучений: β-частицы (электроны, позитроны), протоны (ядра водорода), дейтроны (ядра дейтерия), α-частицы (ядра гелия), тяжелые ионы (ядра других элементов), тг-мезоны.
Радиоактивность изотопов, существующих в природе, называют естественной, а радиоактивность изотопов, полученных в результате различных ядерных реакций, – искусственной.







