
Валерий Александрович Крылов
Каталитический риформинг бензинов. Теория и практика
Глава 3. Начало эры платформинга
Разработка бифункционального платинового катализатора и первое внедрение платформинга на нефтеперерабатывающем заводе Old Dutch.
Триумф платформинга.
Радикальное изменение компонентного пула для получения автомобильных бензинов
Возникший разрыв между технологическими возможностями НПЗ и потребностью рынка в высокооктановых автомобильных бензинах был преодолен в 1949 году введением процесса каталитического риформинга на платиновом катализаторе, получившего название платформинга.
Необходимо заметить, что каталитические свойства платины в реакциях превращения углеводородов были известны с открытия в 1911 году Н.Д. Зелинским реакции дегидрирования циклогексана на платинированном угле [5].
В 1936 году в СССР на Краснодарском НПЗ был внедрен процесс получения толуола с использованием катализатора, представлявшего собой платину на угле (20 % Pt/C) [4].
В этом же году Б.А. Казанский и А.Ф. Платэ (Институт органической химии АН СССР) при исследовании превращения 2,5-диметилгексана на катализаторе Pt/C обнаружили
образование п-ксилола. Так была открыта реакция дегидроциклизации алканов – одна из ключевых реакций ароматизации алканов, лежащих в основе современного каталитического риформинга.
Нет сомнений, что каталитические свойства платины
и возможность ее применения для повышения октановых чисел бензинов были известны немецким химикам из БАСФ, разработавшим процесс DHD.
Существует несколько причин, объясняющих, почему платина не стала первым катализатором промышленного процесса каталитического риформинга.
Прежде всего, высокая чувствительность платины к отравлению серой в значительной степени нивелировала более высокую активность катализатора в реакциях дегидрирования нафтеновых углеводородов.
Нужно отметить, что процесс гидроочистки появился уже после внедрения платформинга как способ защиты платинового катализатора. В то же время сернистые соединения не были помехой для катализаторов на основе оксида молибдена, гидрирующая активность которых после перевода в сульфиды, наоборот, увеличивалась.
Существенным, вероятно, оказалось и то, что бензиновые фракции процесса жидкофазной гидрогенизации угля были обогащены нафтеновыми углеводородами, дегидрирование которых протекало удовлетворительно и на молибденовом катализаторе.
И, наконец, была еще одна причина, возможно, самая главная, почему платина оказалась невостребованной при выборе катализатора нового процесса.
Соотношение цен «платина/автомобильный бензин» было настолько высоким, что делало саму идею процесса на платиновом катализаторе для подавляющего числа исследователей и промышленников абсолютно бесперспективной, тем более для американских нефтяных компаний, выбиравших уже практически готовую технологию для каталитической переработки бензиновых фракций нефти.
Не удивительно, что просьба В. Хензела, работавшего в компании UOP над совершенствованием гидроформинга, о выделении денег для покупки платины для начала работ в новом направлении была встречена прохладно. В. Хензел, однако, был учеником и протеже В.Н. Ипатьева, авторитет которого в компании UOP был непререкаемым. Это обстоятельство и настойчивость самого В. Хензела сделали свое дело: он получил платину для экспериментов.
В начале 1947 года был разработан катализатор
3 %Pt/Al2O3, при испытании которого получены результаты, превосходящие уровень, достигаемый на катализаторе гидроформинга, однако стоимость нового катализатора выходила за рамки разумного.
Настоящий прорыв произошел при обнаружении эффекта кислотного промотора. Как это бывает, вмешался счастливый случай: образец катализатора, недостаточно тщательно отмытый от ионов хлора, вводимых в катализатор при пропитке платинохлористоводородной кислотой H2PtCl6, показал неожиданное увеличение ароматизации сырья.
Это открытие сыграло решающую роль в успехе нового процесса и положило начало развитию бифункционального катализа.
Введение фтора позволило снизить содержание платины в промотированных образцах катализатора до приемлемого уровня – 0,1 %.
Первое промышленное внедрение катализатора R-5 (0,3%Pt/Al2O3-F) состоялось в октябре 1949 года на небольшом НПЗ Old Dutch Refinery (Muskegon, Michigan) на базе реконструированной установки термического риформинга. Реконструкция установки, включая установку реакторов и стоимость загрузки катализатора, были сделаны за счет компании UOP [95].
Установка не имела блока гидроочистки по той причине, что самого процесса гидроочистки на тот момент еще не существовало, и работала, как и ее предшественник, при высоком давлении (70 бар).
Подробная история разработки и внедрения платформинга представлена в литературе [95].
Внедрение платинового катализатора на кислотном носителе революционизировало процесс каталитического риформинга.
Высокая дегидрирующая активность платины в сочетании с применением кислотного носителя обеспечили снижение рабочих температур процесса, увеличение выхода и октанового числа целевого продукта С5+, значительное сокращение скорости накопления кокса и позволили довести продолжительность реакционного цикла до года и более.
Уже к 1962 году большинство установок гидроформинга в США были реконструированы под процесс риформинга на платиновом катализаторе или переведены на гидроочистку сырья риформинга, при этом доля установок с платиновыми катализаторами составила 95,3 % от суммарной мощности каталитического риформинга [21].
Интересно отметить, что на установках платформинга, работавших на негидроочищенном сырье, регенерация катализатора не производилась, вместо этого осуществлялась его замена после каждого реакционного цикла, что было обусловлено сульфатным отравлением при проведении выжига кокса и отсутствием эффективных способов редиспергирования платины.
Изменение структуры производства автомобильных бензинов в США с внедрением процессов гидроформинга и платформинга представлено на рис. 5 [21].
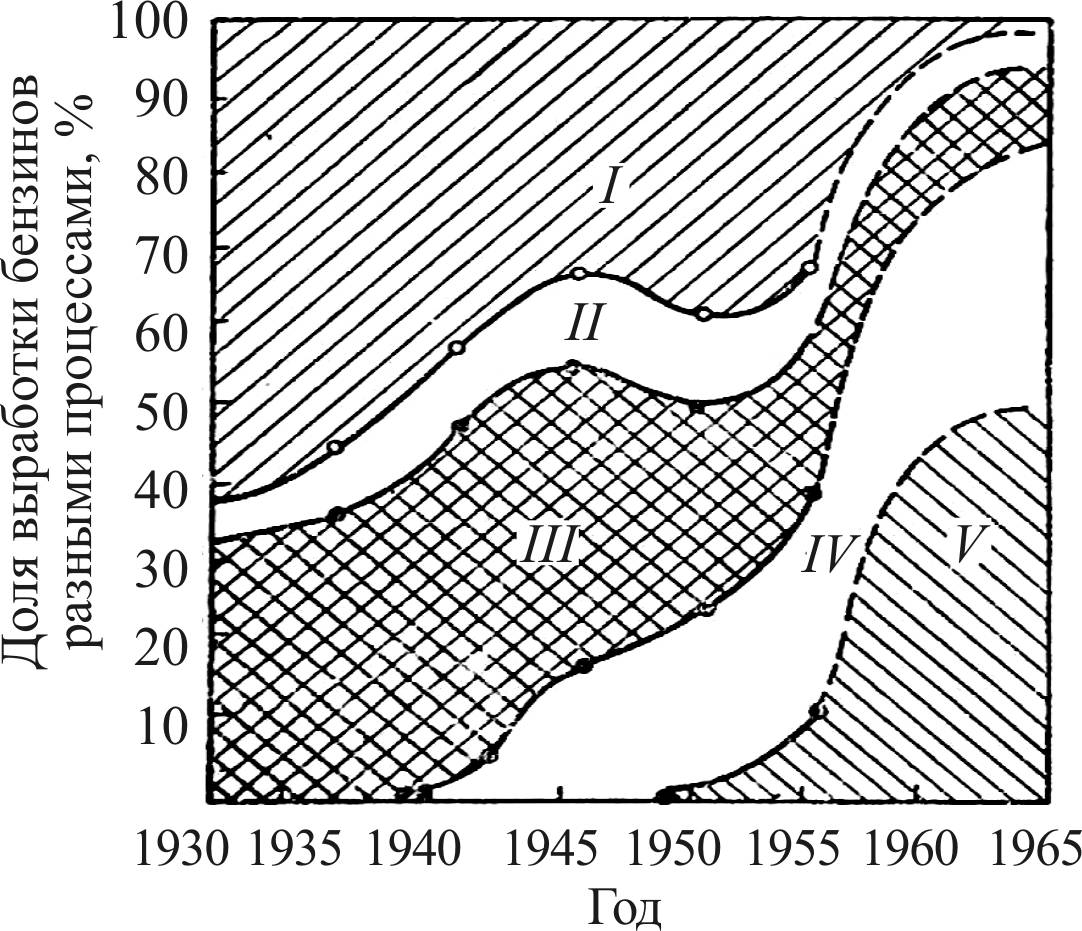
Рис. 5. Удельный объем производства различных бензинов США.
Бензины: I – прямой гонки; II – термического риформинга;
III – термического крекинга; IV – каталитического крекинга;
V – каталитического риформинга
Последующее введение рения в платиновый катализатор явилось еще одним выдающимся событием в развитии процесса каталитического риформинга, обеспечив резкое повышение стабильности катализатора риформинга и улучшение селективности за счет снижения рабочего давления процесса.
Переход от риформинга высокого давления (35–40 бар в продуктовом сепараторе) к процессу при среднем давлении (15–25 бар) позволил организовать рентабельное производство катализата с RON 95–100 пунктов.
Глава 4. Химические реакции
на платиновом катализаторе
Целевые и побочные реакции. Реакции идеального риформинга
Основные отличия в химизме платформинга и гидроформинга обусловлены различиями в металлической и кислотной функциях применяемых катализаторов.
Алюмомолибденовые катализаторы гидроформинга имели слабо выраженную дегидрирующую и изомеризующую активность, связанную с сульфидом молибдена. По существу, это были катализаторы обессеривания, что впоследствии позволило применить их в процессе гидроочистки для защиты катализатора платформинга.
Низкая кислотность катализатора гидроформинга ограничивала протекание реакций С5-циклизации парафиновых углеводородов с последующей изомеризацией в циклогексан и его гомологи.
Активность алюмомолибденового катализатора в реакции ароматизации парафиновых углеводородов была в 10 раз, а для Cr2O3, альтернативного катализатора гидроформинга, – в 100 раз меньше, чем для платинового катализатора Pt/Al2O3.
Ниже представлены основные реакции платформинга.
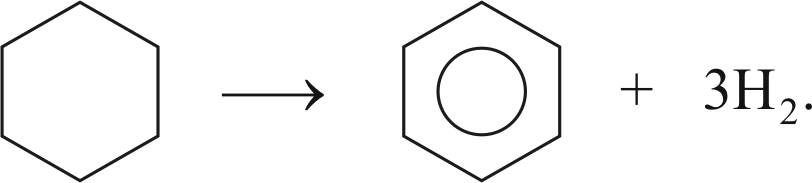
Реакция дегидрирования циклогексана и его гомологов с образованием ароматических углеводородов:
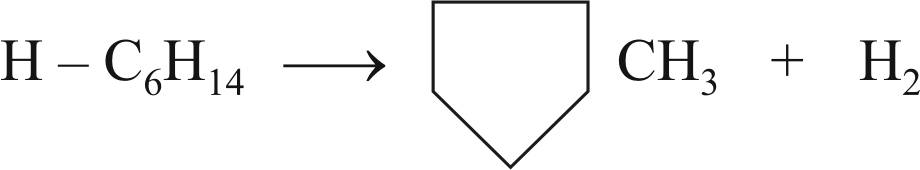
Реакция С5-циклизации парафиновых углеводородов с образованием метилциклопентана и его гомологов; иногда используется другое название – дегидроциклизация до нафтенов:
.
Реакция изомеризации метилциклопентана и его гомологов с образованием соответствующих нафтенов с 6-членным кольцом:
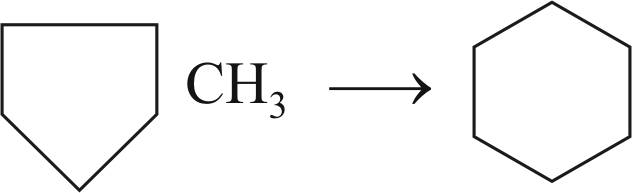
.
Реакция дегидроизомеризации 5-членных нафтенов с образованием ароматических углеводородов; реакция является комбинацией изомеризации и дегидрирования:
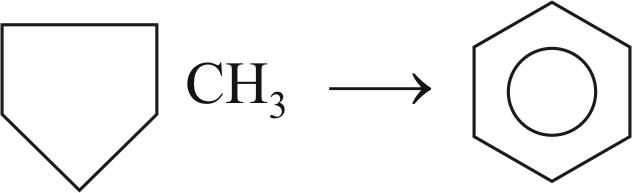
Реакция дегидроциклизации парафиновых углеводородов до ароматических углеводородов; является комбинацией реакций циклизации, изомеризации и дегидрирования:
.
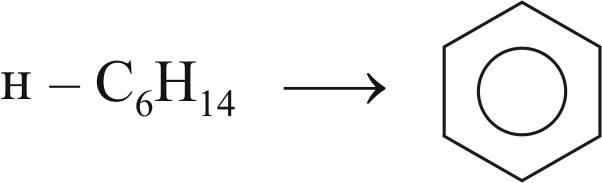
Реакция дегидрирования парафиновых углеводородов:
н – С6Н14 н – С6Н12 + Н2.
Реакция изомеризации парафиновых углеводородов:
н – С6Н14 изомеры гексана.
Побочными и нежелательными реакциями платформинга являются реакции крекинга и коксообразования.
Реакции крекинга включают гидрокрекинг парафиновых углеводородов на кислотных центрах и гидрогенолиз на металлических центрах катализатора:
реакция гидрогенолиза парафиновых углеводородов
реакция гидрокрекинга
Роль отдельных реакций платформинга иллюстрируется на рис. 6: диаграмма построена для риформинга парафинистой бензиновой фракции ближневосточной нефти [9; 68]. На рис. 6 представлены теоретически возможные выходы и октановые числа при условии отсутствия крекинга на платине. Как следует из рисунка, самым эффективным маршрутом для повышения октанового числа является изомеризация и дегидроциклизация парафиновых углеводородов.
Вклад реакции дегидрирования 6-членных нафтенов обычно ограничен в связи с низким их содержанием в бензиновых фракциях нефти.
Гидрокрекинг является нежелательной реакцией, так как приводит к большой потере выхода С5+.
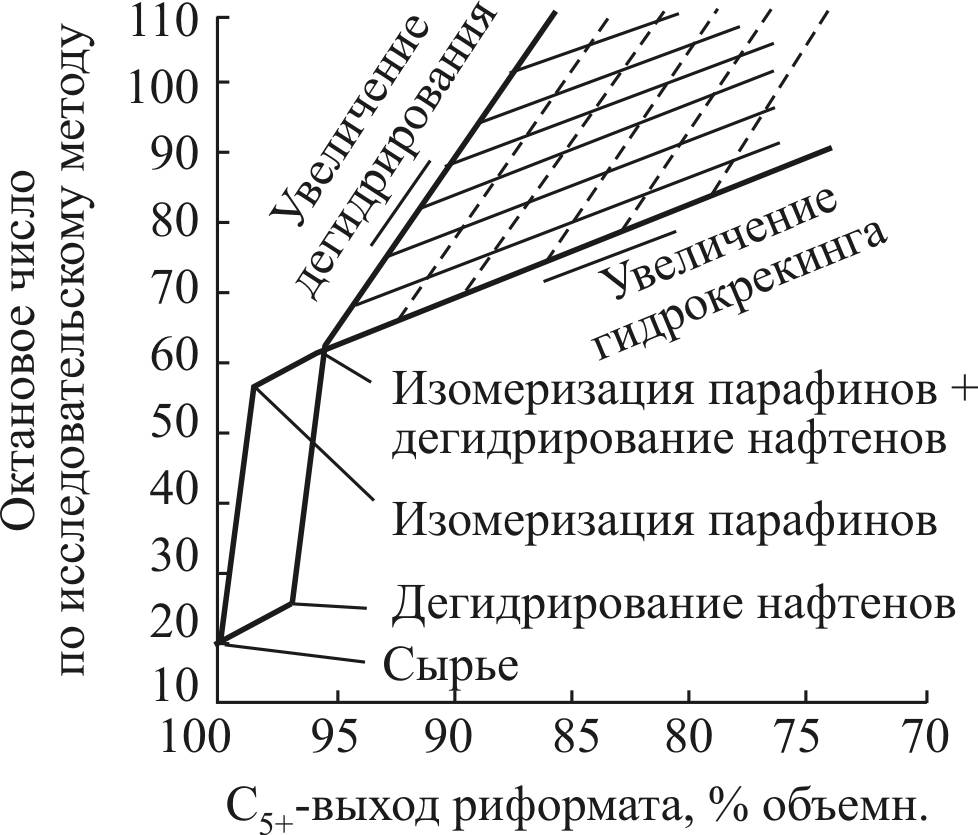
Рис. 6. Вклад отдельных реакций риформинга
в октановое число и выход катализата
Глава 5. Термодинамика
реакций платформинга
Тепловые эффекты, энергии Гиббса и константы равновесия реакций.
Парадоксы равновесия, связанные с протеканием сопряженных реакций.
Влияние температуры и давления на реакции риформинга. Два примера: реакция дегидрирования циклогексана и реакция изомеризации пентана
Основные термодинамические характеристики реакций платформинга включают в себя тепловые эффекты и изменения энтропии, используемые для расчета энергий Гиббса и констант химического равновесия. Ниже, в табл. 2, представлены расчетные значения термодинамических характеристик основных реакций риформинга.
Основные реакции дегидрирования нафтенов и дегидроциклизации парафинов являются сильно эндотермичными. Несколько менее эндотермичны реакции дегидрирования парафинов.
Реакции гидроизомеризации протекают с очень небольшим экзоэффектом.
Умеренно экзотермичны реакции гидрокрекинга и гидрогенолиза парафинов и нафтенов, но вклад этих реакций в общий тепловой эффект невелик в связи с ограничением давления процесса и высокими энергиями активации на платиновом катализаторе.
Превалирование реакции дегидрирования нафтенов и дегидроциклизации парафинов определяет общую высокую эндотермичность процесса и необходимость разделения объема катализатора на несколько слоев с промежуточным печным подогревом реакционной смеси.
Таблица 2
Термодинамические характеристики реакций платформинга
Реакция
кДж/моль
кДж/моль
Kр800
н-гексан ЦГ + Н2
46,3
11,9
0,17
МЦП ЦГ
–14,5
16,8
0,08
н-гексан н-гексен – 1 + Н2
130,5
20,2
0,05
ЦГ Б + 3Н2
220,5
–96,6
1,87Е+6
МЦГ Т + 3Н2
216,5
–101,2
3,7Е+6
н-гексан 2 – МП
–6,0
–1,5
0,8
н-гексан Б + 4Н2
266,8
–84,7
3,1Е+5
МЦП Б + 3Н2
206,0
–79,8
1,19Е+5
н-гексан н-бутан + пропан
–51,5
–53,4
2,9Е+3
н-гексан + Н2 н-гексан + метан
–62,2
–62,3
11,1Е+3
н-гексен – 1 МЦП
–69,7
–25,1
42,6
МЦП-ен ЦГ-ен
+5,6
+10,2
0,218
П р и м е ч а н и е : – энтальпия реакции при температуре 800 К; – изменение энергии Гиббса при температуре 800 К; исходные данные для расчетов взяты в [3].
Эндотермичность риформинга является функцией химического состава сырья и жесткости режима риформирования, задаваемого октановым числом катализата.
Принципиальные ограничения на направление и максимально возможную глубину химических реакций устанавливаются вторым законом термодинамики. В соответствии с этим законом химическая реакция является самопроизвольной (спонтанной) при условии уменьшения энергии Гиббса:
ΔгG < 0.
При химическом равновесии выполняется условие
ΔгG = 0,
где Т – температура реакции; R – газовая постоянная; Kp – константа равновесия химической реакции.
Химическое равновесие является динамическим равновесием системы, при котором существует равенство скоростей прямой и обратной реакций, откуда следует равенство
Kp = K1/K2,
где K1, K2 – константы скорости для прямой и обратной реакции.
В условиях платформинга состояние равновесия достигается для реакций дегидрирования и изомеризации парафиновых и нафтеновых углеводородов.
Не достигают равновесия реакции дегидроциклизации парафиновых углеводородов и реакции гидрокрекинга и гидрогенолиза углеводородов, которые относятся к медленным и очень медленным превращениям соответственно.
Основные химические реакции платформинга протекают с большим уменьшением энергии Гиббса и поэтому имеют высокие значения констант химического равновесия Kp. Исключением являются реакции изомеризации н-алканов и 5-членных нафтенов, а также реакции дегидрирования алканов. Для этих реакций константы равновесия оказываются меньше единицы в связи с небольшим положительным значением энергии Гиббса. Несмотря на невысокие константы равновесия, эти реакции играют важную роль в химической трансформации сырья каталитического риформинга. Ниже это показано на примере реакции изомеризации метилциклопентана в циклогексан.
Роль этой реакции определяется тем, что ароматизация парафинов на бифункциональных катализаторах проходит преимущественно по механизму С5-дегидроциклизации с промежуточным образованием метилциклопентана и его гомологов, поэтому реакция изомеризации циклопентанов является необходимой стадией для образования бензола и его гомологов.
При температуре 800 К изменение энергии Гиббса для этой реакции положительно, и константа Kp равняется 0,08. Это означает, что в равновесной смеси доля метилциклопентана составляет 92,6 % мол.
Поскольку в реальном сырье риформинга отношение
«циклогексан/метилциклопентан» значительно выше равновесного значения, то термодинамика запрещает протекание реакции в прямом направлении, а это делает принципиально невозможным ароматизацию парафиновых углеводородов, которая тем не менее в реальных условиях успешно осуществляется через механизм С5-циклизации. Данное противоречие разрешается при включении в цепочку превращений реакции дегидрирования циклогексана в бензол, которая имеет большое негативное изменение энергии Гиббса. В этом случае суммарное превращение происходит со значительным уменьшением энергии Гиббса (рис. 7).
Действительно, итоговая реакция является суммой реакции изомеризации и дегидрирования.
Поскольку энергия Гиббса является функцией состояния и не зависит от пути перехода, то для итоговой реакции
ΔгGo = +16,8 + (–96,6) = –79,8.
Отсюда константа равновесия может быть определена как произведение констант равновесия реакций изомеризации и дегидрирования или как exp (–ΔгGo/RT) и составит
Kp = 1,19·105.
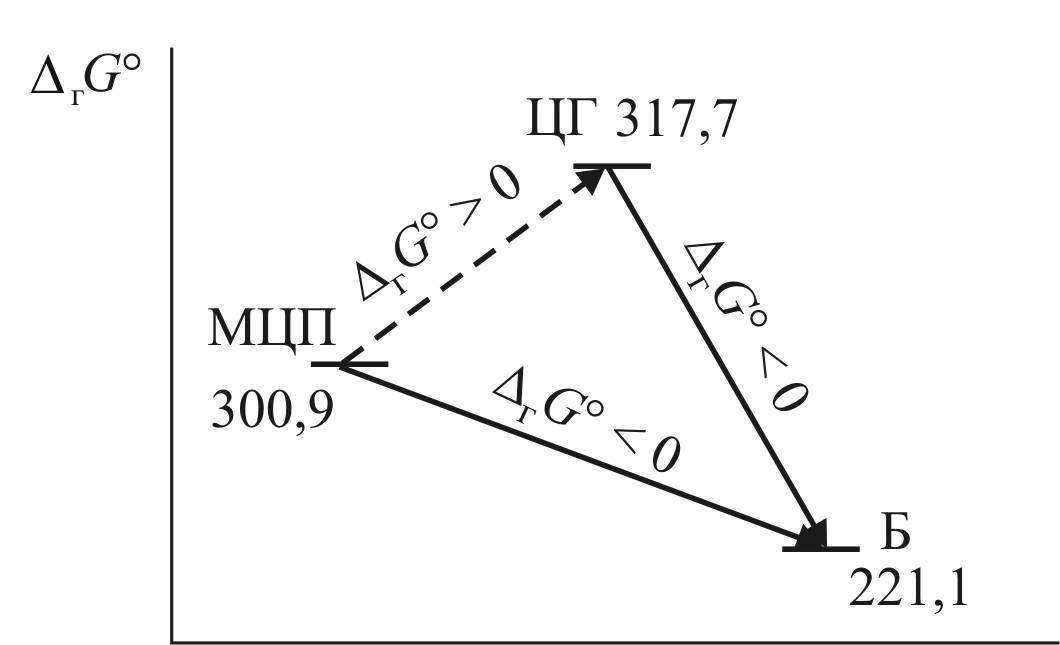
Рис. 7. Изменение энергия Гиббса
в реакции ароматизации метилциклопентана
Механическим аналогом сопряженных химических реакций является устройство, приведенное на рис. 8 [31].
Устройство представляет собой два груза, соединенных канатом.
Сам по себе подъем легкого груза невозможен, это не самопроизвольный процесс, но он становится возможным, если сопровождается опусканием тяжелого груза. Условием, необходимым для сопряжения двух процессов, является наличие механической связи между двумя грузами.
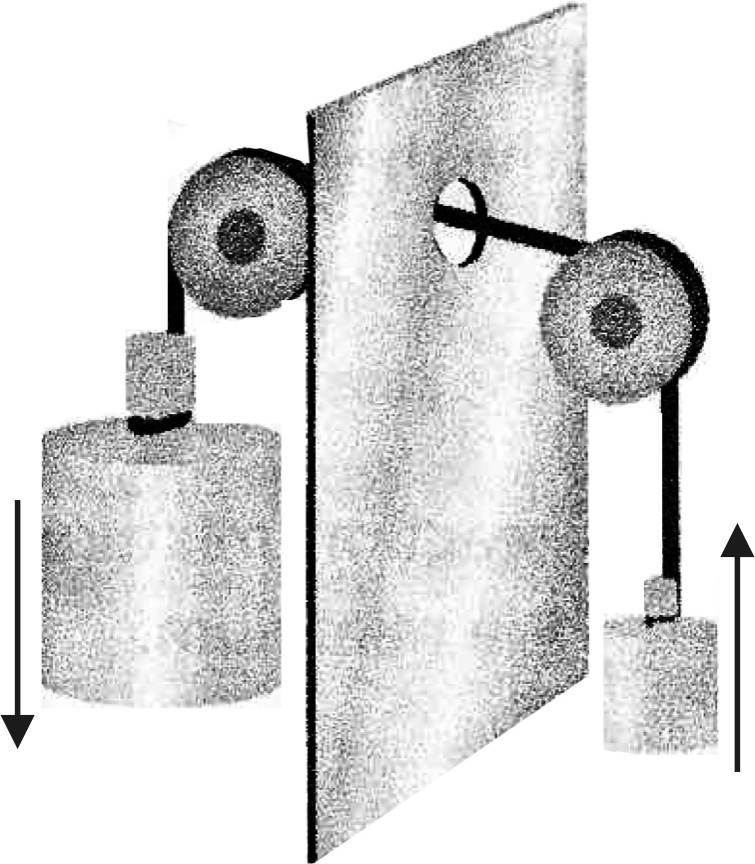
Рис. 8. Механический аналог сопряженных
химических реакций
В химической системе такое сопряжение достигается, если продукт одной химической реакции может расходоваться в другой.
Рассмотренный случай (см. рис. 6) является одним из многих примеров того, как одиночная реакция, невозможная с позиции термодинамики, становится возможной при сопряжении с другой реакцией, обеспечивающей снижение энергии Гиббса для суммарного превращения.
Влияние температуры и давления на константы химического равновесия. Связь изменения температуры и Kр устанавливается уравнением Вант – Гоффа:
dlnKр/dT = ΔH/RT2,
где ΔH – тепловой эффект реакции. Характер зависимости определяется знаком и величиной теплового эффекта реакции.
В соответствии с уравнением Вант – Гоффа увеличение температуры приводит к увеличению Kр эндотермических реакций (ΔH > 0) и возрастанию равновесной степени превращения.
Этот же результат вытекает из принципа Ле Шателье: внешнее воздействие на систему, находящуюся в равновесии, приводит к таким изменениям в системе, которые компенсируют эффект внешнего воздействия.
Наибольшее влияние изменение температуры оказывает на реакции дегидрирования нафтенов и дегидроциклизации парафинов, которые имеют самые высокие значения теплового эффекта. Так, при температуре 800 К изменение энергии Гиббса для суммарной реакции превращения метилциклопентана в бензол составляет, по данным табл. 2, 16,8 + (–96,6) = –79,8 кДж/моль. Этому значению соответствует Kр 1,52Е + 5.
При снижении температуры до 500 К изменение потенциала становится равным +26,1 кДж/моль, и константа равновесия снижается до 1,29; это означает, что в данных условиях суммарная реакция меняет направление и проходит с образованием метилциклопентана.
Ниже приведены расчетные значения энергии Гиббса для температуры в интервале 500–800 К:
Т, К
ΔгG, кДж/моль
800
–79,8
700
–44,2
600
–8,8
500
+26,1
Для наглядности ниже представлены графики изменений потенциалов для двух температур: 800 и 500 К (рис. 9).
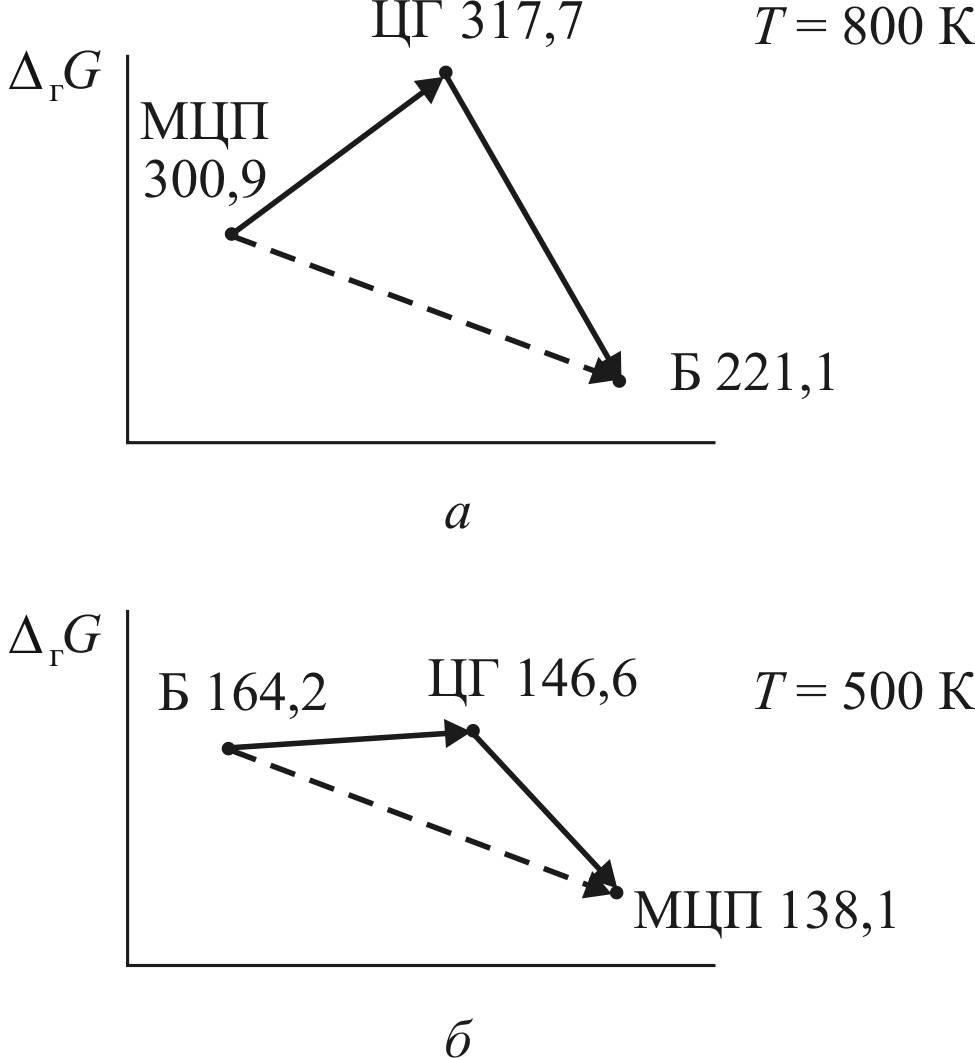
Рис. 9. Изменения потенциалов Гиббса
для двух температур: а – 800 К; б – 500 К
Константа равновесия реакции дегидрирования алканов при температурах платформинга имеет низкое значение, в связи с этим олефины в заметных количествах появляются в продуктах риформинга только при проведении процесса при очень низком давлении, реализуемом на установках платформинга с непрерывной регенерацией катализатора.
Вместе с тем, поскольку эндотермичность реакции обусловливает увеличение константы равновесия при повышении температуры, при достаточно высоких температурах олефины могут быть основным продуктом превращения. Примерами таких процессов являются процессы дегидрирования и термический риформинг.
В целом повышение температуры процесса благоприятствует протеканию основных реакций дегидрирования и дегидроциклизации, что приводит к более глубокой ароматизации сырья.
Давление и константы равновесия связаны уравнением
где Ky – константа равновесия, выраженная в мольных долях реагирующих веществ; сумма ν – изменение стехиометрических коэффициентов реагирующих веществ.
Давление не влияет на величину константы равновесия Kр, которая зависит только от температуры, но может изменять величину Ky, связанную с составом равновесной смеси.
Давление не оказывает влияния на состав равновесной смеси для реакций изомеризации и крекинга, для которых сумма стехиометрических коэффициентов в химическом уравнении равна нулю, в этом случае Ky = Kр.
Наиболее чувствительны к изменению давления реакции дегидрирования нафтенов и дегидроциклизации парафинов. Рост давления оказывает негативное влияние на эти реакции и уменьшает термодинамически возможную степень ароматизации сырья платформинга.
Эффект изменения давления показан на примере расчета состава равновесной смеси для превращения циклогексана при давлении 30 и 10 атм (температура 800 К).
Схема реакций:
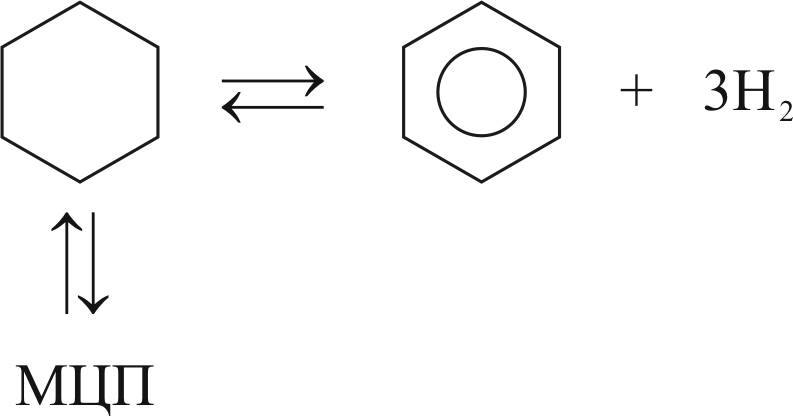
Для расчета мольных долей четырех компонентов равновесной смеси используется система уравнений
Yцг = YбYН2Р3/Kр1,
Yмцп = Kр2Yцг1,
YН2 = 3Yб,
Yцг + Yмцп + Yб + YН2 = 1,
где Kр1 и Kр2 – константы равновесия для реакции дегидрирования и изомеризации циклогексана соответственно.
После упрощения получаем уравнение для расчета Yб:
4Yб + 9Yб3 (Р3 Kр2/ Kр1 + Р3/ Kр1) = 1.
Данное уравнение решается методом подбора.
Результаты расчета в пересчете на смесь углеводородов представлены ниже:
– для давления 30 атм:
Yб = 0,9056,
Yцг = 0,0071,
Yмцп = 0,0881;
– для давления 10 атм:
Yб = 0,9968,
Yцг = 0,0004,
Yмцп = 0,0036.
Как следует из расчетов, конверсия углеводородов в бензол при 30 атм достигает 90 %, снижение давления до 10 атм, уровня, используемого на установках с непрерывной регенерацией катализатора, – увеличивает равновесную конверсию практически до 100 %.
В связи с этим снижение давления процесса является главным инструментом, обеспечивающим более глубокую ароматизацию сырья.
Парафиновые углеводороды составляют основную и самую низкооктановую часть сырья платформинга. Это обусловлено тем, что бензиновые фракции прямой перегонки нефти содержат углеводороды нормального строения и слабо разветвленные изомеры, имеющие небольшие октановые числа.
Ниже представлены октановые числа по исследовательскому методу для изомерных гексанов, гептанов и октанов:
н-гексан – 24,8;
2-метилпентан – 73,4;
3-метилпентан – 74,5;
2,2-диметилбутан – 91,8;
2,3-диметилбутан – 104,3;
н-гептан – 0;
2-метилгексан – 42,4;
3-метилгексан – 56,0;
2,2-диметилпентан – 89,0;
2,3-диметилпентан – 91,4;
2,4-диметилпентан – 83,1;
3,3-диметилпентан – 83,0;
2,2,3-триметилбутан – 112,0;
2-метилгептан – 21,7;
4-метилгептан – 26,7;
3-этилгексан – 33,5;
2,2-диметилгексан – 72,5;
2,4-диметилгексан – 65,2;
2,5-диметилгексан – 55,5;
3,4-диметилгексан – 76,3;
2,2,4-триметилпентан – 100,0;
2,3,3-триметилпентан – 106,1;
2,3,4-триметилпентан – 102,7.
Изомеризация позволяет увеличить октановые числа продукта риформинга, что представляет большой интерес в связи с ограничением содержания ароматических углеводородов в автомобильных бензинах (максимальное текущее значение 35 % объемн.).
В табл. 2 представлены термодинамические данные для расчета реакции изомеризации н-гексана в 2-метилпентан.
Реакция имеет при 800 К небольшое отрицательное значение ΔгG, что обусловливает величину Kр = 0,8, характерную для реакций изомеризации парафинов.
Ниже представлен расчет равновесного состава смеси с учетом образования всех возможных изомеров н-гексана (рис. 10).
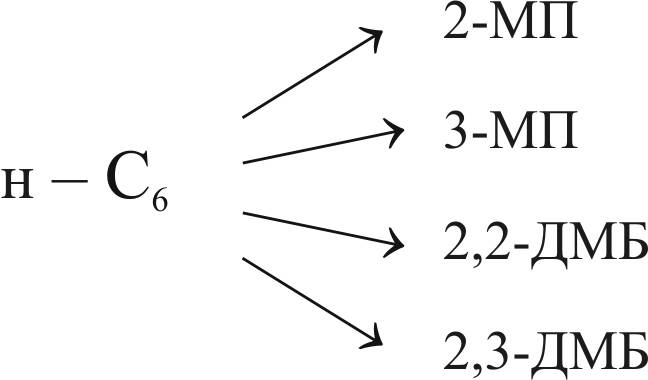
Рис. 10. Схема реакций с образования изомерных гексанов:
2-МП – 2-метилпентан; 3-МП – 3-метилпентан;
2,2-ДМБ – 2,2-диметилбутан; 2,3-ДМБ – 2,3-диметилбутан
В соответствии со схемой реакций в равновесной смеси находится пять компонентов, при этом справедливы следующие соотношения для парциальных давлений компонентов
Рн-г = Р2МП/Kр 2МП = Р3МП/ Kр 3МП = Р2,2ДМБ/ Kр 2,2ДМБ =
= Р2,3ДМБ/ Kр 2,3 ДМБ;
Рнг + Р2МП + Р3МП + Р2,2 ДМБ + Р2,3 ДМБ = Р или
Рнг (1 + Kр 2МП + Kр 3МП + Kр 2,2ДМБ + Kр 2,3ДМБ) = 1.
Отсюда мольные доли компонентов:
Yнг = 1/1 + Kр 2МП + Kр 3МП + Kр 2,2ДМБ + Kр 2,3ДМБ;
Y2МП = Kр 2МП/1 + Kр 2МП + Kр 3МП + Kр 2,2ДМБ + Kр 2,3ДМБ;
Y3МП = Kр 3МП/1 + Kр 2МП + Kр 3МП + Kр 2,2ДМБ + Kр 2,3ДМБ;
Y2,2ДМБ = Kр 2,2ДМБ/1 + Kр 2МП + Kр 3МП + Kр 2,2ДМБ + Kр 2,3ДМБ;
Y2,3ДМБ = Kр 2,3ДМБ /1 + Kр 2МП + Kр 3МП + Kр 2,2ДМБ + Kр 2,3ДМБ.
Результаты расчета равновесных составов для двух температур – 800 К и 700 К, являющихся границами рабочих температур платформинга, – представлены в табл. 3.
Таблица 3
Состав равновесных смесей для двух температур
Компонент
700 К
800 К
н-гексан
2МП
3МП
2,2ДМБ
2,3ДМБ
0,2371
0,3351
0,1809
0,1533
0,0936
0,2692
0,3369
0,1869
0,1215
0,0855
П р и м е ч а н и е : данные в таблице указаны в мольных долях.
Как следует из полученных данных, введение в реакционную схему дополнительных компонентов снижает мольную долю н-гексана при сохранении прочих параметров, что демонстрирует очень сильную зависимость равновесного состава от реакционной схемы. Этот эффект имеет место даже при включении в реакционную схему компонента, образование которого в отдельности термодинамически неблагоприятно, так как и для такого рода реакций Kр > 0, что увеличивает знаменатель в формуле расчета для мольной доли сырьевого компонента.
Интересно отметить, что с увеличением молекулярной массы парафинового углеводорода количество возможных изомеров возрастает, и в связи с этим должно происходить уменьшение равновесной концентрации нормального углеводорода, то есть термодинамическая глубина конверсии парафинов должна увеличиваться с ростом молекулярной массы.
Формально это вытекает из формулы для определения мольной доли компонента, но имеется и более глубокий физический смысл, который состоит в том, что возрастание числа компонентов означает увеличение количества перестановок в химической системе, то есть рост энтропии химической системы в больцмановской интерпретации энтропии. Так, при изомеризации н-гептана (9 компонентов реакционной смеси) равновесное содержание н-гептана при 700 К составляет 0,19 вместо 0,24, полученного для н-гексана (5 компонентов).
Увеличение температуры изомеризации приводит к снижению констант равновесия и равновесной степени превращения в изомеры.
При повышении температуры происходит изменение соотношения между моно-, ди- и триметилзамещенными изомерами с сокращением доли более разветвленных изомеров.
Ниже, на рис. 11, представлено изменение состава реакционной смеси в зависимости от температуры для гептанов.
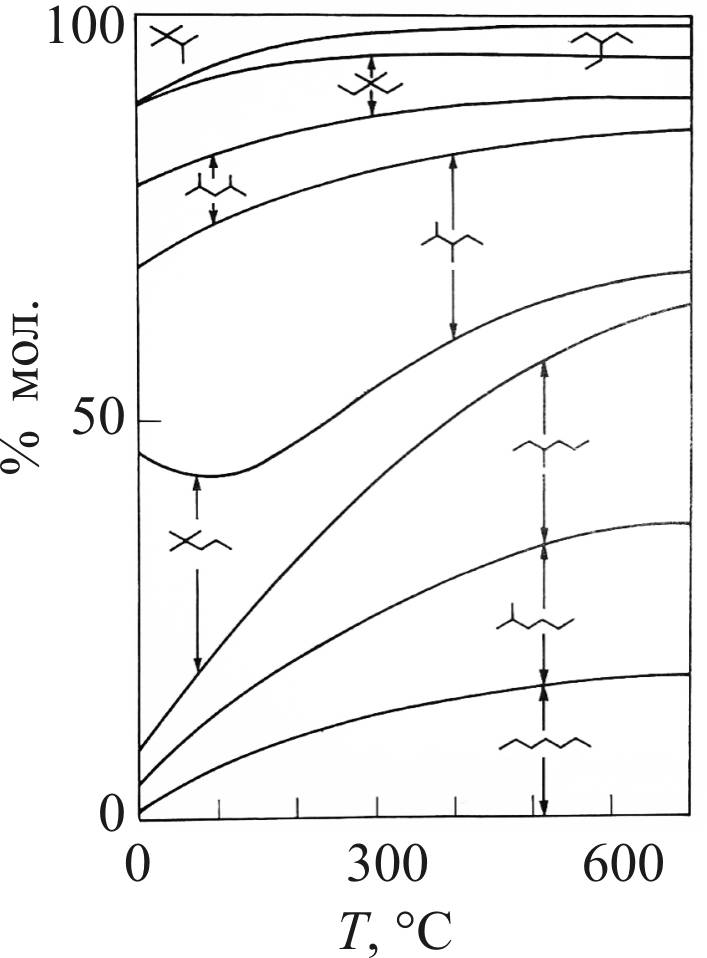
Рис. 11. Состав смеси для реакции изомеризации
для нормального гептана [50]
В целом вклад реакций изомеризации в увеличение октановых чисел катализата платформинга ограничен из-за высоких температур процесса и является второстепенным фактором, в отличие от промышленных процессов изомеризации н-пентана и гексанов, проводимых при существенно более низких температурах.


