
Сен Гук Ким
Элементы
«Всё сущее есть число»
Пифагор
Предисловие
Пифагор не только к тексту, но и к тесту. Тесту на математичность окружающего Мира, Вещественного Мира из химических элементов. Химические элементы – числа: номера химических элементов; числа электронов и нуклонов в атомах химических элементов; квантовые числа… Вся материя в Вещественном Мире из химических элементов: атомы, молекулы, наночастицы, тела, газопылевые туманности, небесные тела, скопления галактик…. Всё (на сегодня) множество химических элементов, составляющих 118 номеров, традиционно распределяют в Периодических Таблицах. Исходя из своих таблиц, известных на то время химических элементов, Д. И. Менделеев открыл Периодический Закон. Но этот фундаментальный Закон Природы оформлен только таблично, сформулирован только словесно, и не имеет математических формул. Таблицы без формул – числовые шифры без ключей. Математические формулы – ключи к числовым шифрам.
Часть I
Введение к Части I
В более чем двухвековой истории систематизации химических элементов наибольших успехов в XIX веке достигли британец Джон Александр Ньюлендс, германец Юлиус Лотар Мейер и россиянин Дмитрий Иванович Менделеев. В последней прижизненной Таблице Менделеева было IX групп:
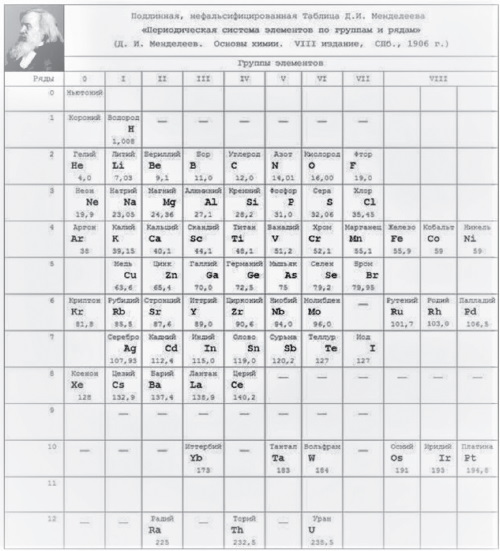
Рис. 1. Последняя прижизненная Периодическая Таблица Д.И. Менделеева
Как видно на рис. 1, у Менделеева была нулевая группа элементов, которая содержала доводородные элементы под номером, очевидно, 0 – Ньютоний (эфир), а под номером 1 – Короний. Водород, по-видимому, имел номер 2, Гелий – номер 3…., и т. д. Дмитрий Иванович почему-то не ставил номера элементам, видимо, полагая это очевидным по порядку расположения элементов в его Периодической Таблице: слева направо в рядах (писал и говорил именно о рядах, а не о периодах) и сверху вниз самих рядов (периодов). В восьмой (девятой от нулевой) группе были только триады: Fe, Со, Ni; Ru, Rh, Pd; Os, Ir, Pt.
Музыкальная октавная гармония, воплощённая в «Законе октав» Ньюлендса в его систематизации химических элементов, имела столь завораживающее воздействие на людей, что 120 лет после открытия Менделеевым Периодического Закона в Мире пользовались Периодической Таблицей химических элементов из VIII гомологических групп элементов-аналогов. В постменделеевский период вплоть до 1989 г. наиболее популярной и повсеместно используемой была Периодическая Таблица вида:
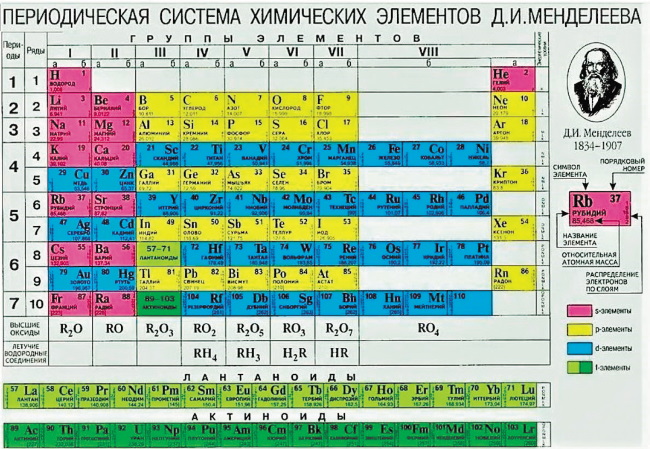
Рис. 2. Наиболее распространённая форма Периодической Таблицы химических элементов до 1989 г.
По сравнению с последней прижизненной Периодической Таблицей Менделеева нулевой группы вместе с нулевым элементом, Коронием и инертными элементами нет, первый номер у Водорода, Гелий и инертные газы из бывшей нулевой группы перенесены в группу VIII, где размещены и триады благородных металлов. Гелий поднялся на один ряд выше и стоит номером 2 в одном ряду с Водородом через 6 групп в крайней правой главной подгруппе VIII группы.
Размещение Гелия над Неоном и другими инертными газами было вполне понятно и оправдано во времена Менделеева, когда не знали о строении атомов, и не было квантовой механики. В самом деле, газ Гелий более инертен, чем все другие благородные газы и имеет наименьшую атомную массу среди них. Поэтому логично было ставить Гелий на первое место типозадающего элемента в гомологической группе инертных атомарных элементов-аналогов.
Но, когда открыли строение атомов, и было установлено, что в явлении периодичности свойств химических элементов лежит квантово-механическая основа формирования электронных оболочек, становится непонятным положение Гелия на рис. 2. Это в таблицах из VIII групп. Но, такая же картина сохраняется и в современных, после 1989 г., типах Периодических Таблиц с 18-ю группами.

Рис. З.Периодическая Таблица химических элементов с 18-тью группами, рекомендуемая IUPAC с 1989 г.
Уже с беглого взгляда на рис. 2 и рис. З отчётливо видно, будто Гелий вырван из естественного положения рядом с Водородом и перекинут на самую правую и верхнюю позицию над Неоном. При этом на обоих рис. 2 и 3 видно, что ячейка с Гелием, по цвету такая же, как у двух групп s-элементов. Как s-элемент Гелий может быть типозадающим в группе p-элементов? Авторы этих Таблиц, по-видимому, таким вопросом не задавались. Если же задавались, то предпочли не выходить за рамки сложившихся в XIX веке традиций. А, ведь, Таблицы на рис. 2 и рис. 3 создавались в середине XX века, когда строение атомов и формирование электронных оболочек на квантово-механической основе были повсеместно признаны и приняты.
Между тем, существует Периодическая Таблица химических элементов по версии Жанета с четырьмя s-элементами в начале (на самом верху, справа, над всеми остальными s-элементами) Таблицы, которую он разработал ещё в конце 20-х годов XX века.
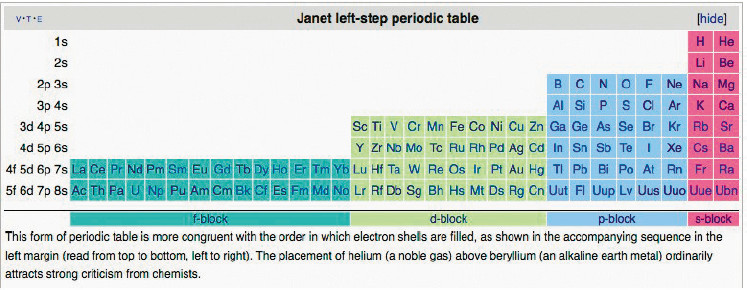
Рис. 4. Периодическая Таблица химических элементов по версии Жанета
Прямоугольные блоки s-, р-, d-, f-элементов компактны и непрерывно последовательны справа налево. Расцветка блоков несколько отличается от привычных для нас красного, желто-оранжевого, синего и зелёного цветов. Но расцветка условна и может отличаться в зависимости от предпочтений и традиций разных народов.
Инертный Гелий возглавляет группу химически очень активных щелочноземельных металлов. Это для подавляющего большинства образованных (со средних школ, лицеев и гимназий) людей совершенно непривычно, более того, не приемлемо. Но если исходить из строения электронных оболочек атомов, то такое расположение Гелия научно оправдано.
Гелий является s-элементом, как щелочноземельные металлы, тогда как все благородные газы, над которыми его традиционно ставят в роли типозадающего в гомологической группе инертных элементов-аналогов, являются р-элементами.
Видно, что проблемы с общепринятыми Периодическими Таблицами химических элементов довольно глубокие. Они связаны с тем, что до сих пор у Периодического Закона химических элементов нет логического обоснования. Для фундаментальных Законов Природы, каковым, безусловно, является Периодический Закон химических элементов, логическим обоснованием может и должно быть математическое обоснование на математических принципах.
В истории систематизации химических элементов было множество попыток охватить все элементы математической формулой. Были попытки и с тригонометрическими, и с экспоненциальными, и со степенными функциями. Но все они потерпели неудачу. По-видимому, по причине того, что фундаментальные законы природы на самом деле просты, и выражаться должны простыми уравнениями. Как Закон всемирного тяготения, Закон электрического взаимодействия, Закон интенсивности света. И в самом деле, выжил и господствовал на протяжении 120 лет простейший математический закон октав из музыкальной гармонии, заложенный Ньюлендсом. Но и здесь были изначально и нарастали со временем проблемы, которые через сто с лишним лет привели к отказу от октавной простоты. В самом деле, Закону октав подчиняются только элементы s и р блоков, от Лития до Оганесона. Химические элементы с номерами 119 и 120 ещё не обнаружены и не синтезированы. Элементы s-, p-блоков отцвечены соответственно бардово-красным и жёлтым цветами на рис. 3. Полных рядов из октавы (восьми) «красных и жёлтых» химических элементов только 6, а элементов соответственно 48 из 118 известных на сегодня химических элементов. Это примерно 40,7 % всех химических элементов. Для истинного, математически выраженного Закона Природы, правомерно ожидать 100 %-го охвата элементов.
Индуктивный (от частного к общему) подход к систематизации химических элементов по мере открытия всё новых элементов оправдан с исторической точки зрения. Но к сегодняшнему дню открытия и синтез новых химических элементов подошли к верхнему пределу множества химических элементов. Настало время для дедуктивной (от общего к частному) систематизации множества химических элементов. Это не означает пренебрежения индуктивным методом, в особенности результатами, полученными к сегодняшнему дню. Напротив, результаты дедуктивного выявления общих математических закономерностей в распределении химических элементов (номеров) должны сопоставляться с известным ныне порядком (нумерацией) распределения химических элементов, полученным индуктивно в течение более двухсот лет.
Наука и просвещение/образование
Обучение, учёба – освоение познанного. Познание – продвижение к непознанному, от освоенного. Наиболее динамичные продвижения в познании за последние 2–3 века сделаны в математике, физике, химии. Тон задавала математика. Что такое теорема? Она формулируется в начале математического исследования, т. е. задаётся сформулированная цель. Остальное – доказательство теоремы, т. е. продвижение к сформулированному в теореме утверждению (истине). Хоть и не столь чётко как в математике, но и в теоретической физике, и в теоретической химии процесс познания идёт по такой же схеме, по такому же алгоритму. Физика и химия – наиболее математизированные естественные науки.
И мы изначально поставим цель – решить Менделеевскую Проблему отсутствия математической формулы у фундаментального естественного Закона Природы – Периодического Закона химических элементов Д.И. Менделеева. Решение будем искать в виде числовой (номерной) систематизации химических элементов.
Всякое научное достижение без его истории, истоков выглядит оторванным, изолированным от общего процесса и потока познания. Поэтому обратимся к числовым истокам и идеям систематизации химических элементов.
1. Двумерное представление множества химических элементов
Изначально, ещё с конца XVIII века химические элементы выстраивали по порядку возрастания атомных весов (масс). Всё множество химических элементов, а их уже в первой четверти XIX века насчитывалось более десятка, выстраивали в ряд. К 60-ым годам XIX века число химических элементов превысило уже 60. Ряд химических элементов стал слишком длинным. Скорее всего, это было главной причиной отступления от прямолинейного отображения множества химических элементов. Первым в этом направлении следует признать Александра де Шанкуртуа, который в 1862 году представил цилиндрическую форму отображения множества химических элементов.
В 1864 году Александр Ньюлендс предложил «закон октав» в двумерном размещении множества химических элементов. Годом позже Лотар Мейер предложил две таблицы по 28 и 22 элемента. Через 5 лет, в 1869 году представил свою Периодическую Таблицу химических элементов Дмитрий Иванович Менделеев. Именно он впервые сформулировал Периодический Закон распределения в системе химических элементов. До 1989 года в мире пользовались короткопериодной Периодической Таблицей химических элементов Д.И. Менделеева с некоторыми изменениями. Примечательно, что в короткопериодной Периодической Таблице химических элементов придерживались «закона октав» Ньюлендса. Таким образом, именно в 60-х годах XIX века произошёл переход от одномерного множества химических элементов к их двумерному множеству. Периодический Закон химических элементов, говорят, «приснился» Д. И. Менделееву именно на двумерном табличном представлении множества известных ему химических элементов.
Как бы то ни было на самом деле, но то, что Периодический Закон распределения химических элементов был выявлен на двумерном табличном представлении химических элементов – исторический факт.
Имеет смысл рассмотреть некоторые конкретные формы таблиц, в клеточках которых будем размещать химические элементы в последовательности 118 номеров, полученной к настоящему времени.
2. Двумерная числовая таблица 10 × 12
Возьмём множество первых 120 чисел натурального ряда, которыми пронумеруем клеточки-квадратики в таблице 10 × 12. Это наиболее простая таблица для чисел привычной всем десятеричной системы счисления. На рисунке ниже представлена такая таблица.
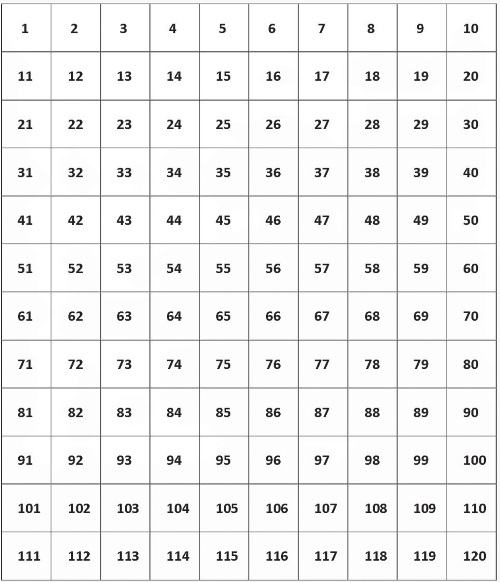
Рис. 5. Таблица 10 × 12 первых 120 чисел натурального ряда
Видна периодичность во всей таблице всех чисел первого разряда в 1-12 строках. Вся таблица периодична. В десятеричной системе счисления так и должно быть. Разряд из 1-10 задаёт (определяет) периодичность любых таблиц из строк в 10 чисел.
Посмотрим, как будет выглядеть таблица 10 × 12 с 118-ю известными на сегодня химическими элементами.
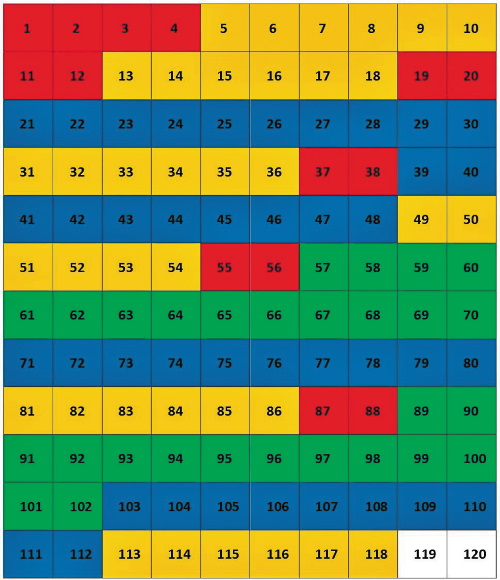
Рис. 6. Номера химических элементов в таблице 10 × 12
Все химические элементы делятся на 4 вида (блока). Они называются блоками s-, р-, d-, f-элементов или s-, р-, d-, f-блоками. Это из квантовой химии, довольно сложной науки. Но для нас важно сейчас только то, что любой химический элемент обязательно является членом одного из 4-х блоков. Нет химических элементов вне этих блоков. Все s-элементы у нас (в СНГ, со времён СССР) традиционно окрашивают в красный цвет, р-элементы – в жёлто-оранжевый, d-элементы – в синий и f-элементы – в зелёный.
Периодичность химических элементов означает, что какие-то ряды полностью повторяются в своих расцветках хотя бы один раз. На рис. 6 таких рядов только 4 из 12, т. е. только ЪЪ,Ъ%. Из этого можно сделать вывод: 12-ти рядная таблица из 10 химических элементов в рядах не пригодна для числового шифрования Периодического Закона.
3. Двумерная числовая таблица 8 × 15
Здесь также 120 чисел. Но 8-ми разрядный «октавный Закон» Ньюлендса был математическим законом Периодической Таблицы химических элементов до 1989 года. Поэтому и мы будем ожидать высокой периодичности во множестве химических элементов в таблице 8 × 15. На рисунке ниже представлена таблица 8 × 15 химических элементов.

Рис. 7. Таблица 8 × 15 химических элементов
Повторяющихся строк 9 из 15 или 72 химических элемента из 118. Это составляет 61 %. Действительно большой процент периодизуемости. Но до 100 % далеко.
Если первые 1–4 химических элемента вынести за пределы таблицы, то получим:

Рис. 8. Таблица 8 × 15 с вынесенными за пределы таблицы первыми 1–4 химическими элементами
Здесь мы имеем 11 периодизирующихся рядов, т. е. 88 из 118 химических элементов. Это составляет около 74,6 %, что выше предыдущего случая на 13,6 %. Хорошая периодизируемость, но также далека от 100 процентной.
4. Двумерная числовая таблица 16 × 8
16-разрядную таблицу рассматриваем в связи с тем, что она кратна 8-ми разрядной таблице, а на 8-ми разрядной таблице достигли максимальной периодичности в 74,6 %. В этом случае в таблице 128 числовых элементов. Таблица химических элементов для этого случая:

Рис. 9. Таблица 16 × 8 химических элементов
Элементы 121–128 относятся к следующему за f-бло-ком g-блоку ожидаемых химических элементов. Но их пока нет. Поэтому химических элементов и в этом случае только 118. В такой таблице имеются 4 периодизи-рующихся рядов, и в них 64 химических элемента. Они составляют примерно 54,23 %. Это намного меньше максимального 74,6 %. Уменьшать или повышать далее разрядность таблиц смысла не имеет. Мы получили весь диапазон «хорошей» периодизируемости химических элементов. К искомому результату – 100 %-му охвату всех химических элементов не подошли и близко.
Вывод: разрядность чисел не может служить основой систематизации химических элементов. Следует искать другие закономерности.


