
Мария Кондратова
Невидимый страж. Как иммунитет защищает нас от внешних и внутренних угроз
Глава 4
СКАНДАЛЬНЫЙ НОБЕЛЬ
Никогда не скрывал, что академическая наука – клубок друзей и серпентарий единомышленников!
Из бурной дискуссии в интернете
Осень 2011 года в научном сообществе выдалась жаркой, даже можно сказать – скандальной. Едва только Нобелевский комитет объявил имена лауреатов по физиологии и медицине, как в кругах ученых-иммунологов началось настоящее брожение. Нет, важности самого открытия и заслуг Брюса Бётлера и Жюля Офмана[2] никто не отрицал, но в дискуссиях постоянно упоминались имена других исследователей, внесших не менее важный вклад в изучение механизмов врожденного иммунитета. Чаще других называли Чарльза Джейнуэя и Руслана Меджитова. Дошло до того, что группа ученых опубликовала в престижнейшем научном журнале Nature статью о допущенной несправедливости. Голоса в защиту Джейнуэя и Меджитова подняли не какие-то озлобленные неудачники, а самые видные специалисты в области иммунологии. Одним из них был Джеймс Эллисон, который сам несколько лет спустя получил Нобелевскую премию за открытие нового типа иммунотерапии злокачественных опухолей (подробнее о его работе мы поговорим в главе, посвященной раку).
Нобелевский комитет, однако, своего решения не изменил, и Руслан Меджитов (Джейнуэй к тому времени уже умер) Нобелевскую премию так и не получил. Но он узнал, как высоко ценят его собратья-ученые и что они готовы сражаться за признание его заслуг – а это, возможно, даже важнее, чем премия. Такая солидарность в ревнивом мире академической науки встречается редко.
Так что же нового удалось узнать ученым за 100 лет, прошедших после открытия Мечникова, и кто из них на самом деле заслуживал Нобелевскую премию? Я постараюсь ответить на первый вопрос, а что до ответа на второй – решайте сами.
Как было сказано выше, в начале и середине XX века все внимание иммунологов было сосредоточенно на клетках приобретенного иммунитета – лимфоцитах. Но постепенно ученые стали догадываться, что адаптивный иммунный ответ совсем не так самодостаточен, как им казалось раньше. Более того, подавляющее количество многоклеточных животных (в том числе, например, такая многочисленная группа, как насекомые) не имеет его вовсе, однако при этом они как-то справляются с инфекциями. Врожденный иммунитет оказался важнее, чем о нем думали. Перед учеными со всей очевидностью встал один из ключевых вопросов иммунологии: каким образом клетки человека, синтезирующие максимум 20–30 тысяч белков, способны распознавать миллионы антигенов вирусов и бактерий?
Для адаптивного иммунитета ответ на этот вопрос был уже известен: распознавание множества вариантов чужеродных молекул связано с генетически обусловленными перестройками в антигенраспознающих рецепторах Т- и В-клеток. Высокая вариабельность генов этих рецепторов и хитроумные перестройки генного локуса позволяют лимфоцитам синтезировать миллионы разнообразных рецепторов, способных распознавать миллионы чужеродных белков. Ничего похожего в клетках врожденного иммунитета не наблюдается, да и созревание миелоидных клеток идет совсем по другому пути, чем созревание лимфоцитов. А между тем рецепторы клеток врожденного иммунитета, как и любые белки, должны быть закодированы генетически. Но как закодировать распознавание миллионов разных микроорганизмов, которые еще и постоянно изменяются? На это нашего генома просто не хватит!
Между тем фагоциты определенно реагировали на присутствие чужеродных молекул. Так, было известно, что некоторые компоненты микробов, например липополисахарид (ЛПС) из клеточной стенки грамотрицательных бактерий, активируют макрофаги, индуцируя секрецию воспалительных цитокинов, и стимулируют деление В-клеток. Но как?
Эта проблема не давала покоя иммунологу Чарльзу Джейнуэю. В 1989 году он опубликовал статью, в которой раскритиковал современную науку за то, что она направляет все внимание на частности, уклоняясь от действительно фундаментальных вопросов, и предложил собственную теорию врожденного иммунного ответа. Согласно теории Джейнуэя, клетки врожденного иммунитета реагируют на общие сигналы о присутствии чужого – он назвал их образами или паттернами патогенности. В этом их отличие от клеток адаптивного иммунитета, нацеленных на распознавание всего одного или нескольких очень похожих антигенов.
Что имеется в виду? Покинем ненадолго сложный микромир и попытаемся понять идею Дженуэя, используя бытовую аналогию. Предположим, вы выстраиваете систему безопасности вокруг дома, стоящего в густом лесу. Из леса могут прийти волки и медведи, и вы хотите, чтобы система отпугивала их громкими звуками и световыми вспышками. При этом вам совершенно не хочется просыпаться всякий раз, когда в огород проберется мышь или заяц. Стало быть, систему нужно правильно настроить, и тут возможны два подхода. Можно, установив множество скрытых камер, научить систему распознавать конкретных животных и реагировать только в том случае, если в поле зрения камеры появится волк или медведь. Так реагирует адаптивная система, распознавая конкретные молекулы антигенов. Но можно поступить иначе и настроить систему так, чтобы она срабатывала на любой объект размером больше зайца. Второй подход гораздо легче реализовать, хотя у него есть свои издержки: время от времени система будет пугать безобидных косуль или соседа, который решил заглянуть к вам на огонек. Именно так – приблизительно – работает врожденный иммунитет.
Возьмем уже упоминавшийся выше ЛПС. В человеческом организме данная молекула не синтезируется, зато ее производит огромное количество бактерий. Если клетка врожденного иммунитета может распознавать это вещество, то она способна распознать множество болезнетворных бактерий. Ей нет необходимости иметь миллионы рецепторов для миллионов разных молекул, которые могут синтезировать все эти бактерии. Достаточно одного-единственного – распознающего ключевую для всех этих микроорганизмов молекулу. Вот такие молекулы, по мысли Джейнуэя, и были теми самыми образами патогенности, которые распознавались клетками врожденного иммунитета. А поскольку каждый такой образ характерен сразу для целой группы патогенов (в случае с ЛПС это все грамотрицательные бактерии[3]), то в конечном счете и рецепторов к ним требуется не так уж много. Не миллионы, а всего лишь десятки.
Коллеги приняли гипотезу Джейнуэя благожелательно, но без восторга. Генетическая инженерия и молекулярная биология в то время делали еще только первые шаги, возможности их были ограниченны. Как найти потенциальные рецепторы к паттернам патогенности среди тысяч белков, которые присутствуют на поверхности иммунных клеток? Ответа на этот вопрос у Джейнуэя не было, и несколько лет его гипотеза оставалась лишь смелой, но ничем не подтвержденной догадкой.
Глава 5
РЕЦЕПТОРЫ, ПОДОБНЫЕ TOLL
Das war ja toll! (Вот это класс!)
Кристиана Нюсляйн-Фольхард
В то время как в США Джейнуэй ломал голову над загадками врожденного иммунного ответа, за океаном, в Европе, немецкая исследовательница Кристиана Нюсляйн-Фольхард изучала различные мутации у плодовой мушки дрозофилы – излюбленного объекта генетиков еще с начала XX века. В 1985 году среди личинок-мутантов она обнаружила нескольких с недоразвитым брюшком. Кристиана отреагировала на открытие, эмоционально воскликнув: «Das war ja toll!» Именно этим словом «toll» (классный, удивительный) был позднее назван ген, мутация в котором так странно нарушала развитие личинки. В 1995 году Кристиана Нюсляйн-Фольхард была награждена Нобелевской премией за открытие генетических механизмов контроля эмбриогенеза.
Где иммунитет, а где эмбриогенез? Но в организме редкий ген и редкий белок выполняют всего лишь одну функцию. Молекулярная жизнь клетки полна неочевидных, но важных связей и взаимодействий. Вскоре выяснилось, что ген Toll важен не только для эмбрионального развития мушек. Оказалось, что он играет важную роль и в жизни взрослых насекомых. В 1996 году французский исследователь Жюль Офман опубликовал статью, в которой говорилось о том, что сигнальный путь толл-рецептора необходим для защиты дрозофилы от грибковых инфекций. Мушки, имевшие мутации в этом гене, погибали от грибка, в то время как обычные мухи были к нему практически нечувствительны.
Это неожиданное открытие оказалось той последней подсказкой, которую так долго ждал Руслан Меджитов. Молодой ученый прочитал статью Джейнуэя, еще будучи аспирантом МГУ, и идея существования паттернов патогенности настолько захватила его, что он поставил себе цель попасть в лабораторию своего кумира. Когда появилась статья Офмана, Меджитов уже несколько лет работал с Джейнуэем, изучая последовательности генов и кодируемых ими белков, чтобы вычислить первый рецептор врожденного иммунного ответа в геноме человека. Здесь мы сделаем небольшое отступление и поговорим о методах биоинформатики, помогающих ученым предсказывать свойства малоизученных белков и генов, которые их кодируют.
Одним из важнейших событий в биологии ХХ века стало открытие генетического кода – системы правил, по которым последовательность нуклеотидов в ДНК (гене) определяет последовательность аминокислотных остатков в кодируемом ею белке. Другим важным событием было осознание того, что последовательность аминокислотных остатков в белке определяет его структуру, а структура, в свою очередь, определяет функцию.
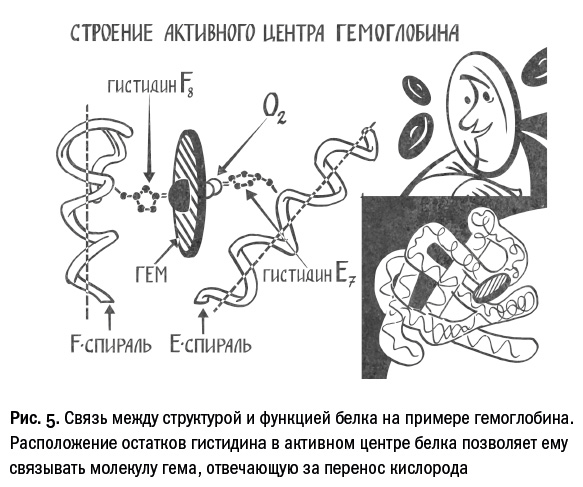
Классическим примером системы «последовательность – структура – функция» является белок гемоглобин, связывающий молекулы кислорода и углекислого газа и осуществляющий их транспорт в нашем организме. Эта функция гемоглобина определяется несколькими остатками аминокислоты гистидина, которые формируют так называемый активный центр белка. Если заменить один из этих гистидинов на остаток какой-то другой аминокислоты, такая молекула не сможет эффективно связывать кислород. Почему именно гистидин? В его состав входит поляризованный атом азота, способный удерживать гем – сложную небелковую молекулу, содержащую атом железа, собственно и связывающий кислород. Однако важен не только химический состав, но и взаимное расположение в пространстве. Остатки гистидина должны находиться на определенном расстоянии друг от друга и под определенными углами. Правильное взаимное расположение обеспечивается стабильностью укладки основных строительных блоков данного белка, которые носят название альфа-спиралей. В свою очередь, эти структуры формируются благодаря чередованию разных типов аминокислот: гидрофильных – любящих воду и гидрофобных – боящихся воды. Таким образом, зная лишь последовательность аминокислот в гемоглобине, мы можем уже довольно много сказать об этом белке. Также вышесказанное позволяет предположить, что гены, обладающие сходными последовательностями, часто кодируют белки с похожими структурами и функциями. Это теоретическое допущение на сегодняшний день имеет множество прямых экспериментальных подтверждений.
Почему это так важно? Дело в том, что прямое определение функции белка и его пространственной структуры продолжает оставаться весьма непростой задачей даже в наши дни. По оценкам ученых, в геноме человека содержится порядка 20 000 генов, кодирующих белки. Но более или менее мы понимаем функции лишь 5000 из них. Что же говорить тогда о миллионах генов, кодирующих белки разных бактерий?
Однако в 1990-х годах определение последовательности генов стало довольно рутинной операцией. Многие тысячи их были уже собраны в первые базы данных – прообразы гигантских биоинформатических хранилищ нашего времени. Специальные программы позволяли сравнивать последовательности генов между собой и находить сходные. Узнав об открытии Офмана, Руслан Меджитов решил искать иголку в стоге сена – проверить, а нет ли среди уже известных человеческих генов похожего на Toll дрозофилы. Конечно, человека и дрозофилу разделяет огромная эволюционная дистанция, но ученые уже знали, что определенные белки, например гистоны, связывающие ДНК в ядре, очень консервативны во всех живых организмах. Возможно, белки иммунной системы также сходны у всех многоклеточных? Во всяком случае, смысл в этих поисках был.
Кто ищет, тот всегда найдет? В науке – отнюдь. Но Меджитову повезло. Он обнаружил в базе данных ДНК последовательность, кодирующую белок, который имел сходство с толл-рецептором дрозофилы. Теперь этот белок известен как толл-подобный рецептор 4 (TLR4). Сходство последовательностей позволяло предположить, что этот белок играет важную роль в защите организма, но само по себе доказательством не являлось. В конце концов, за миллионы лет эволюции, лежащих между человеком и дрозофилой, он мог приобрести другие функции. Чтобы доказать, что этот ген и впрямь вовлечен в иммунный ответ, был необходим эксперимент. На основе исходного гена TLR4 Руслан Меджитов сконструировал искусственный ген, кодирующий мутантный рецептор, который постоянно находится в активном состоянии (природный лиганд, активирующий TLR4, тогда еще не был известен). Мутантный TLR4 поместили в клетки, используя методы генной инженерии, и затем проверили, как отличается активность этих клеток от активности клеток, не подвергшихся генетической трансформации. Оказалось, что гиперактивация сигнальных путей, зависимых от TLR4-рецептора, ведет к усилению производства костимулирующей молекулы В7 и воспалительных цитокинов, необходимых для активации Т-лимфоцитов. Эксперименты Меджитова доказали существование у позвоночных паттерн-распознающих рецепторов, активация которых приводит к инициации адаптивного иммунного ответа. Основное положение теории Джейнуэя было подтверждено. Позже Брюс Бётлер с коллегами показали, что именно рецептор TLR4 связывает липополисахарид клеточных стенок грамотрицательных бактерий.
(На всякий случай напоминаю, что, если термины «лиганды», «рецепторы» и «сигнальные пути», с которыми мы впервые встретились в этой главе, вводят вас в ступор, вы можете обратиться к соответствующим разделам приложения. Разберитесь в этих понятиях сейчас, ведь они еще не раз встретятся в книге. К сожалению, молекулярные механизмы взаимодействия клеток практически не затрагиваются школьным курсом биологии, но в разговоре об иммунной системе без них не обойтись.)
Чарльз Джейнуэй скончался от рака в 2003 году. Жюль Офман и Брюс Бётлер получили Нобелевскую премию в 2011-м. Руслан Меджитов ее так и не получил. Честно говоря, я вполне разделяю негодование Эллисона и других иммунологов. На мой взгляд, вклад Руслана Меджитова в открытие механизмов распознавания во врожденном иммунитете не меньше, чем вклад Офмана и Бётлера. А главное, я в принципе не понимаю, зачем Нобелевскому комитету понадобилась упихивать в одну премию открытие роли толл-подобных рецепторов в клетках врожденного иммунитета и открытие дендритных клеток адаптивного иммунитета. Каждый из этих научных прорывов заслуживал отдельной премии. Однако история не знает сослагательного наклонения, и в итоге получилось то, что получилось: поучительная и немного грустная история о том, что вклад в науку и его признание – это все еще разные вещи. Или же, если хотите, наоборот: поучительная и оптимистичная история о том, что подлинный научный авторитет не зависит от чинов, наград и воли какого-либо комитета, хотя бы даже и Нобелевского.
Изучение толл-подобных рецепторов продолжается и по сей день. Вот что мы знаем о них сегодня. У человека их 10, а, например, у мыши 12, так что врожденный иммунитет у мыши и человека немного различается. Несмотря на общее сходство, толл-подобные рецепторы способны распознавать самые разные чужеродные молекулы: фрагменты ДНК бактерий и РНК вирусов, белки жгутиков бактерий (флагеллин), фрагменты клеточной стенки грибов (зимозан) и многие другие. Также эти рецепторы распознают молекулы, сигнализирующие о проблемах в наших собственных клетках, например белки теплового шока. Как мы увидим дальше, врожденный иммунитет играет важную роль не только в уничтожении чужеродных биологических объектов, но и в очистке организма от старых, больных и раковых клеток. Белки теплового шока и другие подобные им молекулы позволяют клеткам врожденного иммунитета отличать неполноценные клетки от здоровых, нормально функционирующих. Этой стороне иммунного ответа будет посвящена следующая глава.
Глава 6
РЕЦЕПТОРЫ К ЧУЖОМУ… И СВОЕМУ…
…Предоставь мертвым
погребать своих мертвецов.
Евангелие от Луки
После описания первых толл-подобных рецепторов в иммунологии словно плотину прорвало. В следующие 20 лет было открыто множество рецепторов, отвечающих за распознавание во врожденном иммунитете. Некоторые из них имеет смысл рассмотреть особенно внимательно, так это прольет свет на еще одну важную функцию, которую они выполняют. Как мы уже говорили, клетки врожденного иммунитета, особенно макрофаги, – это не только полицейские, но также мусорщики и даже могильщики в нашем организме. Они защищают его не только от внешних врагов, но и от неизбежных внутренних поломок.
Вы наверняка слышали о том, что клетки нашего тела полностью обновляются за семь лет. Это утверждение, конечно, пример не слишком корректного упрощения, но не будем пока к нему придираться. Лучше зададимся вопросом: куда деваются старые клетки, когда им на смену приходят новые? В учебниках на этот счет пишут, что старые клетки погибают и новые занимают их место, однако это мало что объясняет. Мертвая органика, будь то целое тело или отдельная клетка, занимает место, гниет, разлагается, становится питательной средой для разных микроорганизмов. Трупные яды – отрава для живого. История человеческой цивилизации с тех пор, как она стала оседлой, – это история решения похоронного вопроса.
Уже у первобытных людей были специальные места для погребения и ритуалы, решавшие важную для выживания задачу: сделать так, чтобы мертвые не становились опасными для живых. С этим, вероятно, связано и требование многих древних религий хоронить умерших до захода солнца. Любой многоклеточный организм в этом смысле похож на город-миллионник – ему приходится решать те же проблемы утилизации умерших. Как же именно он это делает?
Прежде чем ответить на этот вопрос, имеет смысл уточнить, что смерть клеток, как и смерть людей, бывает естественной и насильственной. Полиция должна присутствовать в обоих случаях. В первом она лишь составляет протокол и выражает дежурное соболезнование близким, но во втором реагирует иначе. Тут уже дело не ограничивается прибытием пары дежурных полицейских – на вызов выезжают сотрудники «убойного отдела», эксперты-криминалисты, выставляется оцепление, начинается поиск и опрос свидетелей. Иммунной системе также нет смысла запускать иммунный ответ на полную катушку, когда в этом нет необходимости. Поэтому клетки врожденного иммунитета по-разному реагируют на естественную смерть клеток от старости и насильственную их гибель в результате механического повреждения, вирусной атаки и тому подобных инцидентов.
Естественная запрограммированная гибель клеток называется апоптозом. Старые клетки совершают что-то вроде самоубийства – молекулярного харакири. В результате внутри них высвобождаются ферменты, похожие на те, которые в нашем пищеварительном тракте помогают переваривать пищу. Клетка в буквальном смысле сама себя переваривает. В конце концов от нее остается лишь несколько небольших пузырьков – апоптотических телец, ограниченных остатками плазматической мембраны. Апоптоз, таким образом, проходит очень аккуратно, и содержимое отмершей клетки не попадает во внеклеточную среду. Специальные молекулы, присутствующие на поверхности апоптотических телец, оставшихся от клеток, умерших естественной смертью, указывают на то, что тельца должны быть утилизированы. Этот тип химических сигналов в научной литературе так и называется – «съешь меня». Его посылает, например, фосфатидилсерин. В норме этот фосфолипид находится во внутреннем слое клеточной мембраны (если вы не помните, что клеточная мембрана двухслойная, – приложение в помощь). В клетках, подвергшихся апоптозу, он переходит в наружный слой и становится сигналом «съешь меня» для множества рецепторов клеток врожденного иммунитета. Фагоциты, главным образом макрофаги, реагируют на эти сигналы и «подъедают» апоптотические тельца, освобождая пространство для новых клеток. Однако делают они это в штатном режиме, не запуская тревожной – воспалительной – реакции. В результате постоянное естественное обновление нашего организма проходит тихо и безболезненно.
Совсем по-другому разворачиваются события, если смерть клетки сопровождается некрозом – разрывом мембраны и выбросом клеточного содержимого во внеклеточное пространство.
Как в этом случае макрофаг распознает поврежденную клетку? Паттерны патогенности здесь не работают, ведь отмершие и разрушенные клетки состоят из тех же молекул, что и здоровые. Сигнальные молекулы типа «съешь меня» зачастую отсутствуют. В этом случае в действие вступают «сигналы о разрушении» (danger signaling), предупреждающие иммунную систему о том, что что-то пошло не так.

Наиболее универсальной «черной меткой» клеточного разрушения являются свободные молекулы ДНК. В норме ДНК всегда находится не просто внутри клетки, а внутри органелл – ядра и митохондрий. Появление ДНК в цитоплазме клетки и тем более во внеклеточном пространстве – это всегда сигнал бедствия, который активирует иммунную систему. Именно этот сигнальный путь (хотя, конечно, не он один) запускает бурную воспалительную реакцию в ране при насильственной гибели клеток. Всем известны признаки воспаления: отек, покраснение, боль, повышение температуры… Это так не похоже на «тихую смерть» от апоптоза.
Свободную ДНК узнают уже знакомые нам толл-подобные рецепторы, например TLR9. Но есть у клеток и другие механизмы распознавания этой молекулы. Один из них связан с активацией белка сGAS-STING (аббревиатура STING расшифровывается как Stimulator of interferon genes – стимулятор интерфероновых генов). Она приводит к тому, что клетки начинают интенсивно производить ключевые воспалительные молекулы – интерфероны (подробнее о них дальше). Тут-то уже иммунный ответ разворачивается по полной…
Перечисленные группы рецепторов отнюдь не исчерпывают всех возможностей клеток врожденного иммунитета реагировать на появление патогенов. О других путях активации врожденного иммунитета, связанных с так называемыми Fc-рецепторами, мы поговорим дальше – в главе, посвященной взаимодействию клеток врожденного и адаптивного иммунитета.
Познакомившись с тем, как клетки врожденного иммунитета отвечают на вызов «распознать», мы переходим к вопросу об их боевом арсенале. У дежурного полицейского есть пистолет и наручники, в распоряжении сил специального назначения имеются автоматы и вертолеты. А что с иммунными клетками?



