
Коллектив авторов
Внутренние болезни. Том 1
1.3. ГИПЕРТОНИЧЕСКАЯ БОЛЕЗНЬ
Определение. Термином «артериальная гипертензия» обозначают синдром повышения АД. Диагностическим критерием АГ является повышение систолического АД до 140 и более мм рт. ст. и/или повышение диастолического АД до 90 и более мм рт. ст.
Гипертоническая болезнь (ГБ) – это хроническое заболевание, основным проявлением которого является синдром АГ, не связанный с наличием патологических процессов, при которых повышение АД обусловлено известными причинами (симптоматические или вторичные АГ). Термин «гипертоническая болезнь» был предложен Г. Ф. Лангом и является синонимом употребляемого в других странах термина «эссенциальная артериальная гипертензия».
Распространенность. Повышенное АД регистрируется в среднем у 25 % взрослых. Частота АГ прогрессивно увеличивается с возрастом: в популяции до 39 лет распространенность АГ составляет 10 – 15 %, в популяции старше 60 лет – более 50 %. У лиц пожилого и старческого возраста несколько реже, чем у людей молодого и среднего возраста, отмечается изолированная диастолическая АГ, но значительно чаще встречается изолированная систолическая АГ.
В Российской Федерации распространенность АГ составляет 39,2 % среди мужчин и 41,1 % среди женщин. Знают о наличии АГ 37,1 % мужчин и 58,9 % женщин. Принимают антигипертензивные лекарственные средства 21,6 % мужчин и 45,7 % женщин, но лечатся эффективно (т. е. достигают нормального уровня АД) всего лишь 5,7 % мужчин и 17,5 % женщин.
АГ является важнейшим фактором риска сердечно-сосудистых заболеваний. Популяционные исследования показали, что у больных ГБ по сравнению с лицами, имеющими нормальное АД, значительно возрастает вероятность развития инсульта, ИБС и хронической сердечной недостаточности. В связи с этим снижение смертности от сердечно-сосудистых заболеваний в немалой степени определяется эффективностью лечения ГБ.
Этиология. Согласно современным представлениям, главным фактором риска развития ГБ является наследственная отягощенность по этому заболеванию. К настоящему времени выявлены многочисленные гены, дефекты которых предрасполагают к АГ. К их числу относятся гены ангиотензинпревращающего фермента (АПФ), ангиотензиногена, ренина, гены, определяющие объем внеклеточной жидкости, реакцию на солевую нагрузку и реабсорбцию натрия, чувствительность тканей к инсулину, проницаемость клеточных мембран, функцию ионных каналов и др. Развитию ГБ способствуют и другие факторы: возраст, избыточная масса тела, потребление поваренной соли в количестве, превышающем физиологическую норму, недостаточное содержание в пище калия, кальция и магния, гиподинамия, курение, злоупотребление алкоголем. Наиболее сильным экзогенным фактором риска ГБ является психоэмоциональный стресс. Важное значение нервно-психического перенапряжения, возникающего после острых и длительных эмоциональных перегрузок, в стабилизации АГ подчеркивалось в классических трудах Г. Ф. Ланга и А. Л. Мясникова. Позднее была обнаружена связь риска развития этого заболевания с особенностями личности. Для пациентов с высоким риском стабилизации АГ характерны скрытая агрессивность, амбициозность, стремление к лидерству, эмоциональная лабильность, торопливость и импульсивность. Эти качества нередко сочетаются с ощущением постоянной тревоги и периодами депрессии.
Развитие ГБ зависит от взаимодействия генетических и средовых факторов. Механизмы этого взаимодействия остаются в полной мере невыясненными. Однако есть основания полагать, что причинно-следственные связи между двумя указанными группами факторов имеют двунаправленный характер: с одной стороны, генетические особенности определяют реакцию организма на факторы внешней среды, а с другой стороны, экзогенные воздействия способствуют проявлению генетических дефектов.
Патогенез. Основными физиологическими параметрами, определяющими уровень АД, являются ударный объем крови, объем циркулирующей крови, эластичность стенок аорты и ее крупных ветвей, сопротивление кровотоку на уровне мелких артерий и артериол, вязкость крови. Ведущую роль в формировании АД играют два гемодинамических показателя: минутный объем кровообращения, представляющий собой произведение ударного объема крови на ЧСС, и общее периферическое сосудистое сопротивление. В условиях нормальной нейрогуморальной регуляции кровообращения объем крови, нагнетаемый сердцем в сосуды, и сосудистый тонус взаимозависимы – изменение одного из этих параметров ведет к противонаправленным изменениям другого. Благодаря сбалансированности минутного объема кровообращения и общего периферического сосудистого сопротивления поддерживается оптимальный для организма уровень АД и предотвращаются его резкие колебания. Нарушение регуляции производительности сердца и сосудистого тонуса, а также их взаимного влияния ведет к неадекватным изменениям АД.
Выделяют следующие варианты изменений центральной гемодинамики, обусловливающие стойкое повышение АД:
1) увеличение минутного объема кровообращения при отсутствии адекватного снижения сосудистого сопротивления;
2) повышение сосудистого сопротивления при отсутствии адекватного уменьшения минутного объема кровообращения;
3) сочетанное повышение минутного объема кровообращения и сосудистого сопротивления.
Распространенность различных гемодинамических вариантов АГ неодинакова. Более чем в 80 % случаев у больных ГБ отмечается повышение общего периферического сосудистого сопротивления.
Согласно нейрогенной концепции патогенеза ГБ, разработанной Г. Ф. Лангом и А. Л. Мясниковым, в основе данного заболевания лежит нарушение регуляции кровообращения, возникающее вследствие перенапряжения и травматизации психической сферы человека. Важную роль в становлении АГ играет активация симпатико-адреналовой системы. На начальном этапе заболевания у многих больных отмечается гиперкатехоламинемия, что проявляется увеличением частоты сердечных сокращений и сократимости миокарда с формированием гипердинамического типа гемодинамики и повышением сосудистого тонуса. Кроме того, симпатикотония сопровождается усилением синтеза других нейрогормонов, способствующих повышению АД за счет влияния на тонус артерий, реабсорбцию натрия и воды (ренин, ангиотензин II, альдостерон, вазопрессин). Активация симпатико-адреналовой системы представляет собой механизм, посредством которого реализуются гемодинамические эффекты психоэмоционального напряжения, что объединяет данную концепцию с нейрогенной концепцией патогенеза ГБ. Вместе с тем существуют и другие причины гиперсимпатикотонии: изменение чувствительности барорецепторов и адренорецепторов, нарушение обратного захвата норадреналина в синаптической щели, снижение тонуса парасимпатической нервной системы.
Развитие АГ может быть связано с расстройством механизмов регуляции водно-солевого обмена, вследствие которого происходит задержка натрия и развивается гиперволемия. Нефросклероз (в том числе и развивающийся на поздних этапах ГБ) является не единственной причиной нарушения экскреторной функции почек. Задержка натрия и воды в организме может быть обусловлена активацией симпатико-адреналовой и ренин-ангиотензин-альдостероновой систем, а также снижением активности системы натрийуретических пептидов. Согласно концепции А. Гайтона, снижение способности почек экскретировать натрий, которое отмечается у ряда больных на раннем этапе заболевания, является не следствием, а причиной АГ. Повышение АД в таких случаях представляет собой компенсаторную реакцию, обеспечивающую усиление натрийуреза и тем самым направленную на поддержание нормального водно-электролитного баланса.
«Мембранная» теория патогенеза АГ, предложенная Ю. В. Постновым и С. Н. Орловым, объясняет повышение АД генетически обусловленным дефектом плазматических мембран, вследствие которого нарушается трансмембранный транспорт ионов кальция. Накопление кальция в цитозоле вызывает повышение тонуса гладкомышечных клеток сосудистой стенки и усиление сократимости кардиомиоцитов, а также способствует активации симпатико-адреналовой системы и сопровождается повышением чувствительности клеток к прессорному действию норадреналина.
В соответствии с современными представлениями, на ранних этапах развития ГБ ведущую роль в повышении АД играет нейрогуморальный дисбаланс, важнейшим проявлением которого является нарушение функционирования ренин-ангиотензин-альдостероновой системы. Основной эффекторный пептид этой нейрогуморальной системы – ангиотензин II – не только циркулирует в кровотоке, но и образуется в тканях. Циркулирующий ангиотензин II вызывает кратковременные эффекты: увеличение частоты сердечных сокращений, вазоконстрикцию, задержку натрия и воды. Тканевой ангиотензин II обусловливает долговременные эффекты активации ренин-ангиотензин-альдостероновой системы, к которым относятся гипертрофия миокарда, формирование и прогрессирование кардиосклероза, гипертрофия гладкомышечных клеток сосудистой стенки, снижение эластичности и стойкое сужение просвета мелких артерий, повышение давления в почечных клубочках с их последующей гибелью и развитием нефросклероза. Активация ренин-ангиотензин-альдостероновой системы способствует развитию дисфункции эндотелия, которая проявляется нарушением баланса секретируемых эндотелиальными клетками биологически активных веществ: продукция оксида азота, фактора гиперполяризации эндотелия и простациклина, обладающих вазодилататорным, антипролиферативным и антиагрегантным свойствами, уменьшается, а выработка эндотелинов, тромбоксана А2 и других соединений, вызывающих вазоконстрикцию, пролиферацию гладкомышечных клеток и агрегацию тромбоцитов, возрастает.
В «метаболической» теории формирования АГ центральная роль отводится инсулинорезистентности тканей. Снижение чувствительности тканей к инсулину обусловлено мутацией генов и воздействием средовых факторов. В большинстве случаев инсулинорезистентность сочетается с ожирением и сопровождается дисфункцией эндотелия, повышением содержания натрия и кальция в гладкомышечных клетках сосудистой стенки, что способствует их пролиферации и повышению чувствительности мелких артерий к вазоконстрикторным влияниям. Следствием инсулинорезистентности является гиперинсулинемия, которая в свою очередь приводит к повышению активности симпатико-адреналовой системы, гипертрофии гладкой мускулатуры сосудов, усилению реабсорбции натрия. Помимо изменений, обусловливающих повышение АД, инсулин стимулирует синтез холестерина и процесс окисления липидов в сосудистой стенке, тем самым способствуя прогрессированию атеросклероза.
Таким образом, механизмы формирования АГ разнообразны. Сочетание патогенетических механизмов, их роль в становлении и прогрессировании ГБ определяются индивидуальным набором генетически детерминированных и средовых факторов каждого пациента.
Морфология. АГ сопровождается развитием морфологических изменений в органах-мишенях, основными из которых являются сердце, артериальные сосуды, почки и головной мозг.
Характерным признаком «гипертонического сердца» является увеличение массы миокарда левого желудочка. В миокарде больных ГБ увеличивается не только масса миоцитов, но и содержание экстрацеллюлярного матрикса, развивается гиперплазия фибробластов и возрастает продукция коллагена, т. е. прогрессирует кардиосклероз. Аналогичные изменения происходят и в стенках магистральных артерий, утолщение и фиброз которых сопровождаются прогрессирующим снижением эластичности. Изменения сосудов почек в сочетании с характерным для АГ нарушением ауторегуляции почечного кровотока приводят к развитию нефросклероза, вплоть до формирования первично сморщенной почки. Поражение сосудов сетчатки при тяжелой АГ проявляется образованием микроаневризм, тромбозами, кровоизлияниями, отеком соска зрительного нерва. Повышенное АД вызывает развитие гипертрофии и липогиалиноза стенки мелких внутримозговых артерий. Вследствие сужения их просвета ухудшается перфузия и происходит разрежение белого вещества головного мозга. Окклюзия мелких внутримозговых артерий приводит к возникновению лакунарных инфарктов, а разрывы микроаневризм – к кровоизлияниям в ткань мозга с последующим формированием кист.
Поскольку АГ ускоряет развитие атеросклероза крупных артерий, соответствующие изменения сосудистой стенки аорты, артерий нижних конечностей, коронарных, мозговых артерий, а также гистологические признаки перенесенных ИМ и ишемических инсультов могут рассматриваться как косвенные морфологические проявления ГБ.
Классификация. Принятая в России и европейских странах классификация величины АД у лиц старше 18 лет представлена в табл. 1.6. Если значения систолического АД и диастолического АД попадают в разные категории, то степень тяжести АГ оценивается по более высокой категории. Наиболее точно степень АГ может быть определена у пациентов с впервые диагностированной АГ и у больных, не принимающих антигипертензивные препараты.
Таблица 1.6
Классификация уровней АД, мм рт. ст.

*Изолированная систолическая АГ должна классифицироваться на 1-ю, 2-ю, 3-ю степень согласно уровню систолического АД.
Результаты суточного мониторирования АД и самостоятельных измерений АД пациентом в домашних условиях могут помочь в диагностике АГ, но не заменяют повторные измерения АД медицинским работником. Критерии диагностики АГ по результатам измерений АД, выполненных врачом, пациентом в домашних условиях, и по данным суточного мониторирования АД различны. О наличии АГ свидетельствуют уровни АД 8 140/90 мм рт. ст. при измерении медицинским работником, 8135/85 мм рт. ст. при измерении пациентом в домашних условиях и среднесуточное АД 8 130/80 мм рт. ст. по данным суточного мониторирования.
Тяжесть АГ, прогноз и тактика лечения больного определяются не только уровнем АД. Помимо определения степени АГ оценка общего сердечно-сосудистого риска включает анализ факторов риска, диагностику поражения органов-мишеней и ассоциированных клинических состояний.
К факторам риска, значимо влияющим на прогноз больных АГ, относятся:
1) величина пульсового АД (у пожилых);
2) возраст (мужчины > 55 лет, женщины > 65 лет);
3) курение;
4) дислипидемия: общий ХС > 5,0 ммоль/л (190 мг/дл), или ХС ЛПНП > > 3,0 ммоль/л (115 мг/дл), или ХС ЛПВП < 1,0 ммоль/л (40 мг/дл) для мужчин и <1,2 ммоль/л (46 мг/дл) для женщин, или ТГ > 1,7 ммоль/л (150 мг/дл);
5) глюкоза плазмы натощак 5,6 – 6,9 ммоль/л (102 – 125 мг/дл);
6) нарушение толерантности к глюкозе;
7) семейный анамнез ранних сердечно-сосудистых заболеваний (у мужчин < < 55 лет, у женщин < 65 лет);
8) абдоминальное ожирение (окружность талии > 102 см для мужчин и > > 88 см для женщин) при отсутствии метаболического синдрома.
О поражении органов-мишеней свидетельствуют признаки гипертрофии левого желудочка, утолщения и снижения эластичности стенок крупных артерий, нарушения функции почек.
К признакам гипертрофии левого желудочка относятся:
1) ЭКГ-критерии: признак Соколова – Лайона (сумма глубины зубца S вотведении V1 и высоты зубца R в отведении V5 или V6) > 38 мм, корнельское произведение (сумма высоты зубца R в отведении aVL и глубины зубца S в отведении V3, умноженная на продолжительность комплекса QRS) > 2440 мм/мс;
2) эхокардиографический критерий: индекс массы миокарда левого желудочка 8125 г/м2 для мужчин и 8 110 г/м2 для женщин.
К признакам поражения сосудов относятся:
1) ультразвуковые признаки утолщения стенки артерии (толщина слоя интима-медиа > 0,9 мм) или атеросклеротические бляшки магистральных сосудов;
2) скорость пульсовой волны от сонной к бедренной артерии > 12 м/с;
3) лодыжечно-плечевой индекс (отношение максимального АД на артериях нижних конечностей — a. dorsalis pedis или a. tibialis posterior – к максимальному АД на плечевой артерии) < 0,9.
К признакам поражения почек относятся:
1) небольшое повышение сывороточного креатинина: 115 – 133 мкмоль/л (1,3 – 1,5 мг/дл) для мужчин или 107 – 124 мкмоль/л (1,2 – 1,4 мг/дл) для женщин;
2) низкая скорость клубочковой фильтрации < 60 мл/мин/1,73 м2 (MDRD-формула) или низкий клиренс креатинина < 60 мл/мин (формула Кокрофта – Гаулта);
3) микроальбуминурия 30 – 300 мг/сут;
4) отношение альбумин/креатинин в моче ³ 22 мг/г (2,5 мг/ммоль) для мужчин и ³ 31 мг/г (3,5 мг/ммоль) для женщин.
Скорость клубочковой фильтрации по MDRD-формуле (мл/мин/1,73 м2)= = 186 ´ (креатинин / 0,88 мкмоль/л)– 1,154 ´ (возраст, годы)– 0,203.
Для женщин результат умножают на 0,742.
Клиренс креатинина по формуле Кокрофта – Гаулта (мл/мин):
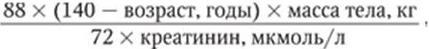
Для женщин результат умножают на 0,85.
Диагностическими критериями сахарного диабета являются:
1) глюкоза плазмы натощак 8 7,0 ммоль/л (126 мг/дл) при повторных измерениях;
2) глюкоза плазмы после еды или через 2 ч после приема 75 г глюкозы > > 11,0 ммоль/л (198 мг/дл).
Диагноз метаболического синдрома устанавливается при сочетании основного и 2 дополнительных критериев из числа приведенных ниже. Основной критерий – абдоминальное ожирение (окружность талии > 94 см для мужчин и > 80 см для женщин). Дополнительные критерии: АД ³ 130/85 мм рт. ст.; ХС ЛПНП > 3,0 ммоль/л; ХС ЛПВП < 1,0 ммоль/л для мужчин и < 1,2 ммоль/л для женщин, ТГ > 1,7 ммоль/л; гипергликемия натощак ³ 6,1 ммоль/л, нарушение толерантности к глюкозе – глюкоза плазмы через 2 ч после приема 75 г глюкозы ³ 7,8 и £ 11,1 ммоль/л.
Ассоциированные клинические состояния диагностируются при наличии следующих признаков.
Цереброваскулярная болезнь:
1) ишемический мозговой инсульт;
2) геморрагический мозговой инсульт;
3) транзиторная ишемическая атака.
Заболевания сердца:
1) ИМ;
2) стенокардия;
3) коронарная реваскуляризация;
4) хроническая сердечная недостаточность (СН).
Заболевания почек:
1) диабетическая нефропатия;
2) почечная недостаточность: сывороточный креатинин > 133 мкмоль/л (1,5 мг/дл) для мужчин и >124 мкмоль/л (1,4 мг/дл) для женщин.
Заболевания периферических артерий:
1) расслаивающая аневризма аорты;
2) симптомное поражение периферических артерий.
Гипертоническая ретинопатия:
1) кровоизлияния или экссудаты;
2) отек соска зрительного нерва.
В зависимости от степени повышения АД, наличия факторов риска, признаков поражения органов-мишеней, сахарного диабета, метаболического синдрома и ассоциированных клинических состояний пациенты, страдающие АГ, могут быть отнесены к одной из 4 групп: низкого, среднего, высокого и очень высокого дополнительного риска (табл. 1.7). Низкому риску соответствует вероятность развития сердечно-сосудистых осложнений и смерти от них в ближайшие 10 лет < 15 %, среднему риску – 15 – 20 %, высокому – 20 – 30 % и очень высокому > 30 %. Оценка общего сердечно-сосудистого риска является обязательным компонентом диагностики АГ и имеет большое значение при выборе тактики лечения больного.
Клиническая картина. Специфической симптоматики ГБ не существует. На начальном этапе заболевания и при медленном прогрессировании АГ многие больные вообще не испытывают каких-либо неприятных ощущений.
Таблица 1.7
Стратификация риска у больных АГ
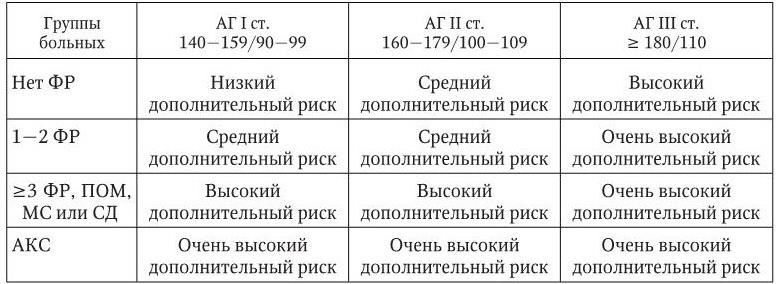
Примечание. Точность определения общего сердечно-сосудистого риска напрямую зависит от того, насколько полным было клинико-инструментальное обследование больного. Без данных ультразвукового исследования сердца и сосудов для диагностики гипертрофии левого желудочка и утолщения стенки (или бляшки) сонных артерий до 50 % больных АГ могут быть ошибочно отнесены к категории низкого или умеренного риска вместо высокого или очень высокого.
Наиболее характерной для ГБ жалобой больного является головная боль, которая в большинстве случаев появляется при повышении АД до определенного уровня либо при его резких изменениях. Часто головная боль, обусловленная АГ, локализуется в затылочной области, но нередко больные испытывают боль в лобной, теменной, височных областях. Кроме головной боли типичными для ГБ являются преходящие нарушения зрения в виде мелькания «мушек» и «тумана» перед глазами. Стойкие нарушения зрения, в том числе и слепота, развиваются при поражении сетчатки – дегенеративных изменений, кровоизлияний, тромбоза артерий. Многие больные предъявляют жалобы на повышенную утомляемость, слабость, снижение работоспособности, раздражительность, плохой сон, эмоциональную лабильность. Помимо невротических нарушений ГБ может проявляться умеренной ноющей болью или тяжестью в области сердца. В отличие от стенокардии эти ощущения не провоцируются физической нагрузкой и не купируются нитроглицерином. Их появление обычно бывает связано с эмоциональным напряжением и повышением АД. В то же время у пациентов с сопутствующей ИБС резкий подъем АД может привести к развитию типичного ангинозного приступа в связи с возрастанием постнагрузки и повышением потребности миокарда в кислороде. У некоторых больных при повышении АД возникают носовые кровотечения.
При прогрессировании ГБ в клинической картине заболевания начинают преобладать симптомы, обусловленные атеросклерозом различных сосудистых бассейнов: коронарных, мозговых, периферических артерий. У больных появляются стенокардия, признаки хронической цереброваскулярной недостаточности, перемежающаяся хромота. Нередко формируется и хроническая СН. Причем нарушение насосной функции сердца проявляется не только у больных с сопутствующей ИБС, приводящей к снижению сократимости миокарда. При выраженной гипертрофии левого желудочка хроническая СН может развиваться вследствие диастолической дисфункции сердечной мышцы.
Объективное исследование больных ГБ на начальном этапе заболевания позволяет выявить некоторые неспецифические изменения, обусловленные повышением АД: твердый пульс, умеренную тахикардию, при наличии выраженной гипертрофии левого желудочка – усиление верхушечного толчка, акцент II тона над аортой. По мере прогрессирования заболевания и развития осложнений появляются дополнительные симптомы: систолический шум над основанием сердца, обусловленный атеросклерозом восходящего отдела аорты, расширение границ относительной сердечной тупости влево при дилатации левого желудочка, IV тон из-за изменения силы и скорости сокращения левого предсердия при повышении диастолического давления в полости левого желудочка. Формирование ассоциированных клинических состояний сопровождается соответствующими клиническими признаками. Например, двигательными и сенсорными расстройствами у больных, перенесших острые нарушения мозгового кровообращения; ослаблением, отсутствием и асимметрией пульса, похолоданием и трофическими нарушениями кожи нижних конечностей при выраженном атеросклеротическом сужении соответствующих артерий. Развитие хронической СН, помимо дилатации левого желудочка, манифестируется появлением систолического шума митральной регургитации, в случае выраженного снижения сократительной функции миокарда – III тона, а также застойных хрипов в легких.
Точность диагностики и определения степени АГ зависит от соблюдения правил измерения АД.
Измерение АД необходимо проводить в спокойной и удобной обстановке после отдыха, продолжительность которого должна составлять не менее 5 мин. Пациент должен сидеть, опираясь на спинку стула с расслабленными нескрещенными ногами. Рука, на которой измеряется АД, должна быть обнажена и расположена на столе таким образом, чтобы середина манжеты, наложенной на плечо, находилась на уровне сердца пациента. АД рекомендуется измерять через 1 – 2 ч после приема пищи. В течение 1 ч перед измерением АД исключается употребление кофе и крепкого чая, курение, отменяется прием симпатомиметиков, включая назальные и глазные капли. Нижний край наложенной на плечо манжеты должен быть расположен на 2 – 2,5 см выше локтевого сгиба. Раздуваемая часть манжеты должна охватывать не менее 80 % окружности плеча. На каждой руке выполняются не менее двух измерений АД с интервалом не менее минуты. При разнице результатов, превышающей 5 мм рт. ст., производят дополнительное измерение и за конечное значение АД принимают средний из результатов двух последних измерений. Воздух нагнетается в манжету быстро до величины давления, на 20 мм рт. ст. превышающего систолическое АД, ориентировочный уровень которого определяется по исчезновению пульса на лучевой артерии. АД измеряют с точностью до 2 мм рт. ст. Скорость снижения давления в манжете составляет около 2 мм рт. ст. в секунду. Значение систолического АД определяют по появлению I фазы тонов Короткова. Уровень давления в манжете, при котором происходит исчезновение тонов (V фаза тонов Короткова), соответствует диастолическому АД. Если тоны Короткова выслушиваются при очень низких величинах АД (что может наблюдаться у детей, при тиреотоксикозе, лихорадке, аортальной недостаточности, у беременных), значение диастолического АД определяют по началу IV фазы, т. е. при значительном ослаблении тонов. Повторные измерения АД производят после полного стравливания воздуха из манжеты.
Лабораторная и инструментальная диагностика. Обследование больного АГ начинается с применения простых методов, обязательных для каждого пациента. Если по данным анамнеза и физикального исследования не обнаруживаются признаки поражения органов-мишеней и ассоциированных клинических состояний, а также не возникает предположения о вторичной АГ, применения дополнительных методов исследования не требуется. Однако в ряде случаев, например для подробной оценки состояния больного с осложненным течением заболевания или уточнения причин вторичной АГ, возникает необходимость проведения не только дополнительного, но и углубленного исследования больного.
К обязательным методам исследования относятся:
1) клинический анализ крови;
2) общий анализ мочи;
3) определение глюкозы в плазме крови (натощак);
4) определение содержания в сыворотке крови общего ХС, ХС ЛПНП, ХС ЛПВП, ТГ, креатинина;
5) определение клиренса креатинина (по формуле Кокрофта – Гаулта) или скорости клубочковой фильтрации (по формуле MDRD);
6) ЭКГ.
К методам исследования, рекомендуемым дополнительно, относятся:
1) определение содержания в сыворотке крови мочевой кислоты и калия;
2) эхокардиография;
3) определение микроальбуминурии;
4) исследование глазного дна;
5) УЗИ почек и надпочечников;
6) УЗИ брахиоцефальных и почечных артерий;
7) рентгенография органов грудной клетки;
8) суточное мониторирование и самоконтроль АД;
9) определение лодыжечно-плечевого индекса;
10) определение скорости пульсовой волны (показатель ригидности магистральных артерий);
11) пероральный тест толерантности к глюкозе – при уровне глюкозы в плазме крови > 5,6 ммоль/л (100 мг/дл);
12) количественная оценка протеинурии (если применение диагностических полосок подтвердило наличие микроальбуминурии).
К методам углубленного исследования относятся:
1) для оценки состояния больного с осложненной АГ – исследование головного мозга, миокарда, почек, магистральных артерий;
2) для выявления вторичных форм АГ – исследование в крови концентрации альдостерона, кортикостероидов, активности ренина; определение катехоламинов и их метаболитов в суточной моче и/или плазме крови; брюшная аортография; компьютерная томография или магнитно-резонансная томография надпочечников, почек и головного мозга.
В процессе проведения лабораторно-инструментального обследования больного АГ большое значение придается диагностике поражения и контролю состояния органов-мишеней, так как это позволяет определить риск сердечно-сосудистых осложнений, оценить эффективность и безопасность антигипертензивной терапии.
Для оценки состояния сердца применяются электрокардиография и эхокардиография, по результатам которых можно рассчитать вольтажные критерии гипертрофии левого желудочка (индекс Соколова – Лайона и корнельское произведение) и определить индекс массы миокарда левого желудочка. По соотношению толщины задней стенки левого желудочка и его радиуса с учетом индекса массы миокарда левого желудочка эхокардиография позволяет определить тип ремоделирования левого желудочка, что важно для оценки прогноза. Критерии диагностики концентрической, эксцентрической гипертрофии и концентрического ремоделирования левого желудочка представлены на рис. 1.2.
Прогностически наименее благоприятной является концентрическая гипертрофия левого желудочка. Кроме размеров полостей и толщины стенок сердца эхокардиография позволяет оценить систолическую и диастолическую функции левого желудочка.
Для диагностики поражения магистральных артериальных сосудов проводится ультразвуковое исследование общей сонной артерии. Признаком гипертрофии стенки артерии является умеренное увеличение толщины слоя интимамедия. Величина этого показателя, превышающая 1,3 мм, расценивается как признак атеросклеротического поражения артерии. С помощью допплерографии на сосудах лодыжки и плеча может быть более точно, чем по результатам обычного измерения АД, рассчитан лодыжечно-плечевой индекс, снижение которого считается косвенным признаком выраженного атеросклероза артерий нижних конечностей. В последние годы большое значение в оценке вероятности развития сердечно-сосудистых осложнений придается снижению эластичности (повышению жесткости) крупных артерий, вследствие которого увеличивается скорость распространения пульсовой волны. Увеличение скорости распространения пульсовой волны на участке между сонной и бедренной артериями сопряжено с повышенным риском осложнений.
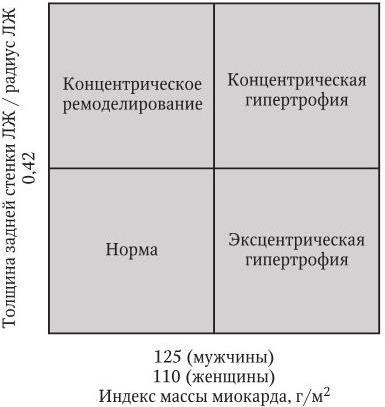
Рис. 1.2. Типы ремоделирования левого желудочка
Диагностика патологии почек и уточнение их функционального состояния базируются на результатах исследования уровня креатинина в сыворотке крови и экскреции белка с мочой. У всех больных рассчитывается клиренс креатинина по формуле Кокрофта – Гаулта или скорость клубочковой фильтрации по формуле MDRD. У всех больных проводится исследование наличия белка в моче при помощи тест-полосок. При отрицательном результате рекомендуется применение специальных методов выявления микроальбуминурии, диагностическим критерием которой является потеря белка в количестве 30 – 300 мг/сут. Микроальбуминурия расценивается не только как диагностический критерий нефропатии, но и как признак системной сосудистой патологии. Существует непрерывная прямая связь между количеством альбумина в моче и риском сердечно-сосудистых осложнений.
Исследование глазного дна целесообразно выполнять у молодых пациентов и больных с тяжелой АГ. Небольшие изменения сосудов сетчатки являются неспецифическими и нередко выявляются вне связи с АГ. Выраженные изменения (экссудаты, кровоизлияния, отек соска зрительного нерва) ассоциируются с повышенным сердечно-сосудистым риском.


