
Коллектив авторов
Полный справочник медицинской аппаратуры
Магнитно-резонансная томография
Магнитно-резонансная томография (МРТ) – способ получения диагностических изображений органов и тканей организма человека, в основе которого лежит феномен ядерно-магнитного резонанса.
Магнитно-резонансная томография в последнее время заняла одно из ведущих мест в неинвазивной инструментальной диагностике. Постоянное развитие методики позволяет периодически находить новые сферы использования МРТ. Если сначала ее применение ограничивалось исследованиями центральной нервной системы, то в настоящее время МРТ используют в диагностике заболеваний практически всех органов и систем.
В 1946 г. ученые из США Феликс Блох и Ричард Пурселл независимо друг от друга открыли явление ядерного магнитного резонанса (ЯМР) для жидкостей и твердых тел. В 1952 г. оба ученых были удостоены Нобелевской премии по физике, методику ЯМР стали использовать в физической и органической химии, биофизике, биохимии. В 1972 г. П. Лаутербур, используя методику ЯМР, получил первое в мире двухмерное изображение двух стеклянных капилляров, заполненных жидкостью. Уже в 1980–1981 гг. в клиниках появились первые магнитно-резонансные томографы для исследования организма человека. После начала использования ядерного магнитного резонанса для медицинской диагностики термин «ядерный» был опущен из соображений маркетинга и по настоянию специалистов по радиологии. Это связано с негативным восприятием понятия «ядерный» массовым сознанием, с которым ЯМР не имеет ничего общего. Поэтому в наши дни используется термин «магнитно-резонансная томография».
В основе работы всех МР-томографов лежит явление магнитного резонанса. Этот физический феномен основан на возможности некоторых ядер атомов под действием магнитного поля поглощать энергию внешнего источника в радиочастотном диапазоне, а затем и выделять ее, возвращаясь на исходный энергетический уровень. При этом напряженность постоянного магнитного поля и частота радиочастотного магнитного поля должны строго соответствовать друг другу, что обеспечивает возникновение ядерного магнитного резонанса. Наиболее интересными являются ядра 1Н, 13С, 23Na, 31Р, так как все они присутствуют в теле человека. Для МРТ разработаны различные импульсные последовательности, которые в зависимости от цели определяют вклад того или иного параметра в интенсивность изображения исследуемых структур для получения оптимального контраста между нормальными и измененными тканями.
Для создания магнитного резонанса необходимо постоянное, стабильное и однородное магнитное поле.
В зависимости от напряженности магнитного поля все МР-то-мографы обычно делятся на сверхнизкие (менее 0,1 Тл), низкопольные (0,1–0,4 Тл), среднепольные (0,5 Тл), высокопольные (1–2 Тл), сверхвысокопольные (выше 2 Тл). Приборы, имеющие напряженность магнитного поля до 0,3 Тл, обычно имеют ре-зистивные или перманентные магниты, выше 0,3 Тл – сверхпроводящие. В практике верхний предел напряженности магнитного поля составляет 2–2,5 Тл, это предел безопасности магнитного поля для человеческого организма. Свыше этого предела поля предполагаются потенциально опасными и могут допускаться для использования только в исследовательских лабораториях. Более 70 % всех МР-томографов составляют модели со сверхпроводящими магнитами (0,5–1,5 Тл). В настоящее время в отличие от 1980-х гг. основные фирмы-производители МР-томографов («Дженерал Электрик», «Сименс», «Филипс», «Тошиба», «Пикер», «Брукер» и др.) особое внимание уделяют производству устройств со средним и низким полем, которые отличаются от высокопольных томографов компактностью, экономичностью при удовлетворительном качестве изображений и меньшей стоимости. Высокопольные системы используются преимущественно в научно-исследовательских центрах для проведения МР-спектроскопии.
МРТ не имеет ничего общего с рентгенологическими методами исследований, однако при ее развитии и внедрении в практику был использован опыт рентгеновской компьютерной томографии (КТ). К моменту возникновения МРТ КТ уже активно использовалась в клинической практике, внедрение МРТ стало возможным благодаря преимуществам этого метода обследования по сравнению с КТ.
К основным достоинствам МРТ относятся:
1) неинвазивность;
2) безвредность (отсутствие лучевой нагрузки);
3) трехмерный характер получения изображений;
4) естественный контраст от движущейся крови;
5) отсутствие артефактов от костных тканей;
6) высокая дифференциация мягких тканей;
7) возможность выполнения МР-спектроскопии для прижизненного изучения метаболизма тканей).
К основным недостаткам обычно относят достаточно большое время, необходимое для получения изображений (как минимум, несколько секунд, обычно – минуты), что приводит к появлению артефактов от дыхательных движений (что особенно снижает эффективность исследования легких), нарушений ритма (при исследовании сердца), невозможность надежного выявления камней, кальцификатов, некоторых видов патологии костных структур, достаточно высокую стоимость оборудования и его эксплуатации, специальные требования к помещениям, в которых находятся приборы (экранирование от помех), невозможность обследования больных с клаустрофобией, искусственными водителями ритма, крупными металлическими имплантатами из немедицинских металлов.
Противопоказания к МРТ-исследованию делятся на абсолютные и относительные. К абсолютным относят состояния пациентов, при которых проведение исследования создает угрожающую для их жизни ситуацию (например, наличие имплантатов, которые активируются электронным, магнитным или механическими путями, искусственных водителей ритма). Воздействие радиочастотного излучения МР-томографа может нарушить функционирование стимулятора, работающего в системе запроса, так как изменения магнитных полей могут имитировать сердечную деятельность. Магнитное притяжение может вызвать также смещение стимулятора в гнезде и сдвинуть электроды. Кроме того, магнитное поле создает препятствия для работы ферромагнитных или электронных имплан-татов среднего уха. Наличие искусственных клапанов сердца представляет опасность и является абсолютным противопоказанием только при исследовании на МР-томографах с высокими полями, а также если клинически предполагается повреждение клапана. К абсолютным противопоказаниям к исследованию относится также наличие небольших металлических хирургических имплантатов (ге-мостатических клипс) в центральной нервной системе, так как их смещение вследствие магнитного притяжения угрожает кровотечением. Их наличие в других частях тела имеет меньшую угрозу, так как после лечения фиброза инкапсулирование зажимов помогает удержать его в стабильном состоянии. Однако, помимо потенциальной опасности, наличие металлических имплантатов с магнитными свойствами в любом случае вызывает артефакты, создающие сложности для интерпретации результатов исследования.
К относительным противопоказаниям, помимо перечисленных выше, относятся также некомпенсированная сердечная недостаточность, необходимость физиологического мониторинга (механическая вентиляция легких, электрические инфузионные насосы).
Клаустрофобия является препятствием для проведения исследования в 1–4% случаев. Преодолеть его можно, с одной стороны, использованием приборов с открытыми магнитами, с другой – подробным объяснением устройства аппаратуры и хода обследования.
Что касается обследования беременных женщин, свидетельств повреждающего действия МРТ на эмбрион или плод не получено, однако рекомендовано избегать МРТ в первые 3 месяца беременности. Применение МРТ при беременности показано в случаях, когда другие неионизирующие методы диагностической визуализации не дают удовлетворительной информации. МР-томографическое обследование требует большего участия в нем больного, чем КТ, так как движения больного во время исследования значительно сильнее влияют на качество изображений, поэтому исследование больных с острой патологией, нарушенным сознанием, спастическими состояниями, деменцией и детей нередко бывает затруднительным.
При заболеваниях головного мозга первоначально предпочтение должно отдаваться КТ как более экономичному и быстрому методу (время исследования пациента при КТ обычно в 2–2,5 раза меньше, чем при МРТ). МРТ применяется для уточнения результатов КТ, если в этом есть необходимость. Однако, если имеются подозрения на наличие поражения мозга в области задней черепной ямки, ствола, мелкоочаговых или диффузных поражений белого вещества (например, рассеянный склероз, энцефалиты, лакунарные инфаркты), необходима неинвазивная оценка состояния интракраниальных артерий (аневризмы, артериовенозные маль-формации), то целесообразно начинать обследование сразу с МРТ. Парамагнитные контрастные средства позволяют более эффективно выявлять патологию центральной нервной системы.
При исследованиях спинного мозга и межпозвонковых дисков в шейном и грудном отделах МРТ предпочтительнее КТ, так как она позволяет получать сагиттальные срезы, не дает артефакты от костных структур и не требует введения контрастных средств.
МРТ (особенно системы со сверхпроводящими магнитами) имеет ряд преимуществ перед КТ 3-го и 4-го поколений при исследовании сердца и магистральных сосудов. Появление МР-ан-гиографии и динамических программ (кино-МР) еще более расширило возможности МРТ в диагностике сердечно-сосудистой патологии. Сегодня с помощью МРТ возможна достоверная оценка не только анатомии, но и функции сердца, внутрисердечной гемодинамики, перфузии миокарда.
Визуализация органов малого таза у мужчин и женщин – еще одна область, где МРТ, как правило, имеет преимущества перед КТ. На МР-изображениях хорошо видны зональная анатомия матки, предстательной железы, инвазия опухолей в жировую клетчатку и мышцы, лимфатические узлы.
При исследовании печени, селезенки, почек и надпочечников, выявлении опухолей средостения и шеи диагностические возможности МРТ сопоставимы примерно с таковыми КТ, поэтому по упомянутым выше причинам предпочтение отдается КТ. Существуют отдельные ситуации, когда МРТ может дать больше информации, чем КТ (например, при выявлении мелких геман-гиом, оценке степени инвазии сосудистых структур брюшной полости, диагностике вне надпочечниковых феохромоцитов).
Несомненны достоинства МРТ при исследованиях суставов. На МР-изображениях очень хорошо видны хрящевые поверхности суставов, мениски, связочный аппарат. Метод позволяет выявлять метастатические поражения костей, остеомиелит, аваску-лярные некрозы еще на той стадии, когда они затрагивают лишь костный мозг и не вызывают деструкции костных структур, видимой на рентгеновских изображениях.
Применение МРТ практически не имеет смысла при легочной патологии, заболеваниях желчного пузыря, в выявлении камней, кальцификатов, переломов костей. МРТ не применяется для диагностики заболеваний желудка и кишечника.
Появляются новые методики исследования, вводятся в практику МР-контрастные препараты. Особенно интересной представляется разработка органоспецифических агентов (т. е. веществ, специфических для определенного типа нормальных или патологических тканей).
Наиболее интенсивные работы ведутся по совершенствованию методик МР-ангиографии, кино-МРТ, подавлению артефактов от дыхания, МР-спектроскопии, трехмерному сбору и реконструкции изображений.
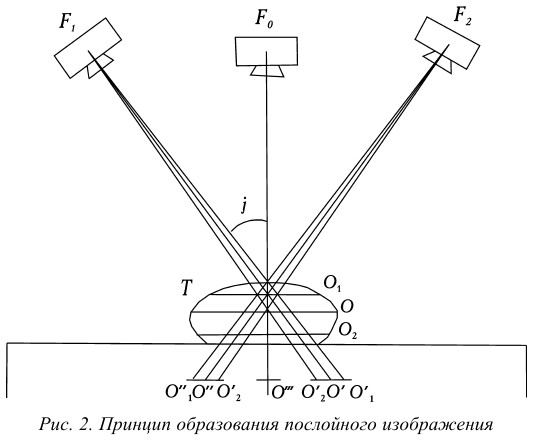
На рисунке 2 изображен принцип образования послойного изображения:
F 0, F 1, F 2 – нулевое, исходное и конечное положение фокуса рентгеновской трубки;
j – 1/2 угла поворота трубки;
S – поверхность стола;
Т – объект исследования;
О – точка выделяемого слоя;
О1, О2 – точки, находящиеся выше и ниже выделяемого слоя;
О`, О» – проекции точки О на пленке при исходном и конечном положениях фокуса рентгеновской трубки;
О1 `, О1 » – проекции точки О1 на пленке при тех же положениях фокуса трубки;
О2 `, О2 » – проекции точки О2 при тех же положениях фокуса трубки;
«` – проекции всех точек на пленке при нулевом положении рентгеновской трубки.
Глядя на рисунок, видно, что при перемещении трубки из положения F1 в положение F2 проекция точки О, которая соответствует оси вращения рычага, будет постоянно находиться в одном и том же месте пленки. Проекция точки О неподвижна относительно пленки, и следовательно, ее изображение будет четким. Проекции точек О1 и О2, находящиеся вне выделяемого слоя, с перемещением трубки и пленки меняют свое положение на пленке, и следовательно, их изображение будет нечетким, размазанным. Доказано, что геометрическим местом точек, проекции которых при движении системы неподвижны относительно пленки, является плоскость, параллельная плоскости пленки и проходящая через ось окончания системы. На томограмме, таким образом, будут четкими изображения всех точек, находящихся в плоскости на уровне оси вращения системы, т. е. в выделяемом томографическом слое.
На рисунке показано перемещение трубки и пленки по траектории прямая-прямая, т. е. по параллельным прямолинейным направляющим. Такие томографы, имеющие самую простую конструкцию, получили наибольшее распространение. В томографах с траекториями дуга-дуга, дуга-прямая геометрическим местом точек, проекции которых при движении системы неподвижны относительно пленки, являются плоскости, параллельные плоскости пленки и проходящие через ось качания системы; выделяется также слой плоской формы. Из-за более сложной конструкции эти томографы получили меньшее распространение.
Описанные выше аппараты относятся к линейным томографам (с линейными траекториями), так как проекции траекторий движения системы «трубка – пленка» на выделяемую плоскость имеют вид прямой линии, а тени размазывания имеют прямолинейную форму.
За угол поворота (качания) трубки 2i в таких томографах принимают угол ее поворота из одного крайнего положения в другое; перемещение трубки от нулевого положения равно i.
В томографах с нелинейным размазыванием перемещение системы «трубка – пленка» происходит по криволинейным траекториям – кругу, эллипсу, гипоциклоиде, спирали. При этом отношение расстояний фокус трубки – центр вращения и центр вращения – пленка сохраняется постоянным. И в этих случаях доказано, что геометрическим местом точек, проекции которых при движении системы неподвижны относительно пленки, является плоскость, параллельная плоскости пленки и проходящая через ось качания системы. Размазывание изображения точек объекта, лежащих вне выделяемой плоскости, происходит по соответствующим кривым траекториям движения системы. Размазываемые изображения повторяют на пленке траекторию перемещения фокуса рентгеновской трубки.
При симультанной (многослойной) томографии в один прием (одно перемещение трубки и пленки в противоположных направлениях) получают несколько томограмм благодаря расположению в одной кассете нескольких пленок, расположенных на некотором расстоянии друг от друга. Проекция изображения первого слоя, находящегося на оси вращения системы (избранной высоте слоя), получается на верхней пленке. Геометрически доказано, что на последующих пленках получают свое изображение нижележащие параллельные оси движения системы слои, расстояния между которыми примерно равны расстояниям между пленками. Основным недостатком продольной томографии является то, что расплывчатые изображения выше– и нижележащих плоскостей с нежелательной информацией уменьшают естественную контрастность. Вследствие этого восприятие в выделяемом слое тканей с невысокой контрастностью ухудшается.
Указанного недостатка лишена аксиальная компьютерная рентгеновская томография. Это объясняется тем, что строго кол-лимированный пучок рентгеновского излучения проходит только через ту плоскость, которая интересует врача. При этом регистрация рассеянного излучения сведена к минимуму, что значительно улучшает визуализацию тканей, особенно малоконтрастных. Снижение регистрации рассеянного излучения при компьютерной томографии осуществляется коллиматорами, один из которых расположен на выходе рентгеновского пучка из трубки, другой – перед сборкой детекторов.
Спиральная КТ используется в клинической практике с 1988 г., когда компания Siemens Medical Systems представила первый спиральный компьютерный томограф. Спиральное сканирование заключается в одновременном выполнении двух действий: непрерывного вращения источника – рентгеновской трубки, генерирующей излучение, вокруг тела пациента и непрерывного поступательного движения стола с пациентом вдоль продольной оси сканирования z через апертуру гентри. В этом случае траектория движения рентгеновской трубки относительно оси z – направления движения стола с телом пациента – примет форму спирали.
В отличие от последовательной КТ скорость движения стола с телом пациента может принимать произвольные значения, определяемые целями исследования. Чем выше скорость движения стола, тем больше протяженность области сканирования. Важно то, что скорость движения стола может быть в 1,5–2 раза больше толщины томографического слоя без ухудшения пространственного разрешения изображения.
Технология спирального сканирования позволила значительно сократить время, затрачиваемое на КТ-исследование, и существенно уменьшить лучевую нагрузку на пациента.
Мультиспиральная (мультисрезовая) МСКТ была впервые представлена компанией Elscint Co в 1992 г. Принципиальное отличие МСКТ-томографов от спиральных томографов предыдущих поколений состоит в том, что по окружности гентри расположены не один, а два и более ряда детекторов. Для того чтобы рентгеновское излучение могло одновременно приниматься детекторами, расположенными на разных рядах, была разработана новая – объемная – геометрическая форма пучка. В 1992 г. появились первые двухсрезовые (двухспиральные) МСКТ-томографы с двумя рядами детекторов, а в 1998 г. – четырехсрезовые (четырехспиральные) – с четырьмя рядами детекторов соответственно. Кроме вышеотмеченных особенностей, было увеличено количество оборотов рентгеновской трубки с 1 до 2 в секунду. Таким образом, четырехспиральные МСКТ-томографы 5-го поколения на сегодняшний день в 8 раз быстрее, чем обычные спиральные КТ-томографы 4-го поколения. В 2004–2005 гг. были представлены 32– и 64-срезовые МСКТ-томографы.
Преимущества МСКТ перед обычной спиральной КТ:
1) улучшение временного разрешения;
2) улучшение пространственного разрешения вдоль продольной оси z;
3) увеличение скорости сканирования;
4) улучшение контрастного разрешения;
5) увеличение отношения сигнал / шум;
6) эффективное использование рентгеновской трубки;
7) большая зона анатомического покрытия;
8) уменьшение лучевой нагрузки на пациента.
Все эти факторы значительно повышают скорость и информативность исследований.
Методики контрастного усиления позволяют различать и определять характер опухолей (новообразований) на фоне окружающих их мягких тканей в тех случаях, когда они не видны при обычном исследовании.
Лучевая нагрузка при мультиспиральном КТ-исследовании при сопоставимых объемах диагностической информации меньше на 30 % по сравнению с обычным спиральным КТ-исследова-нием. Для этого улучшается фильтрация спектра рентгеновского излучения и производится оптимизация массива детекторов. Разработаны алгоритмы, позволяющие в реальном масштабе времени автоматически уменьшать ток и напряжение на рентгеновской трубке в зависимости от исследуемого органа, размеров и возраста каждого пациента.
В 2005 г. компанией Siemens Medical Solutions представлен первый аппарат с двумя источниками рентгеновского излучения. Теоретические предпосылки к его созданию были еще в 1979 г., но технически его реализация в тот момент была невозможна. По сути он является одним из логичных продолжений технологии МСКТ. Дело в том, что при исследовании сердца (КТ-коронаро-графии) необходимо получение изображений объектов, находящихся в постоянном и быстром движении, что требует очень короткого периода сканирования. В МСКТ это достигалось синхронизацией ЭКГ и обычного исследования при быстром вращении трубки. Но минимальный промежуток времени, требуемый для регистрации относительно неподвижного среза для МСКТ при времени обращения трубки, равном 0,33 с (~ 3 оборота в секунду), равен 173 мс, т. е. половине периода обращения трубки.
Такое временное разрешение вполне достаточно для нормальной частоты сердечных сокращений. Некоторое время пытались увеличить скорость вращения трубки в гентри томографа. В настоящее время достигнут предел технических возможностей для ее увеличения, так как при обороте трубки в 0,33 с масса ее возрастает в 28 раз (перегрузки 28g). Чтобы получить временное разрешение менее 100 мс, требуется преодоление перегрузок более чем 75g. Использование же двух рентгеновских трубок, расположенных под углом 90°, дает временное разрешение, равное четверти периода обращения трубки (83 мс при обороте за 0,33 с). Это позволило получать изображения сердца независимо от частоты сокращений.
Также такой аппарат имеет еще одно значительное преимущество: каждая трубка может работать в своем режиме (при различных значениях напряжения и тока, кВ и мА соответственно). Это позволяет лучше дифференцировать на изображении близкорасположенные объекты различных плотностей. Особенно это важно при контрастировании сосудов и образований, находящихся близко от костей, или металлоконструкций. Данный эффект основан на различном поглощении излучения при изменении его параметров у смеси кровь + йодсодержащее контрастное вещество при неизменности этого параметра у гидроксиапатита (основы кости) или металлов.
В остальном аппараты являются обычными МСКТ-аппарата-ми и обладают всеми их преимуществами.
Известно, что при одинаковой энергии рентгеновского излучения материал с большей относительной молекулярной массой будет поглощать рентгеновское излучение в большей степени, чем вещество с меньшей относительной молекулярной массой. Подобное ослабление рентгеновского пучка может быть легко зафиксировано. Однако на практике мы имеем дело с совершенно неоднородным объектом – телом человека. Поэтому часто случается, что детекторы фиксируют несколько рентгеновских пучков одинаковой интенсивности, в то время как они прошли через совершенно различные среды. Это наблюдается, например, при прохождении через однородный объект достаточной протяженности и неоднородный объект с такой же суммарной плотностью.
При продольной томографии разницу между плотностью отдельных участков определить невозможно, поскольку «тени» участков накладываются друг на друга. С помощью компьютерной томографии решена и эта задача, так как при вращении рентгеновской трубки вокруг тела пациента детекторы регистрируют 1,5–6 млн сигналов из различных точек (проекций), и что особенно важно, каждая точка многократно проецируется на различные окружающие точки.
При регистрации ослабленного рентгеновского излучения на каждом детекторе возбуждается ток, соответствующий величине излучения, попадающего на детектор. В системе сбора данных ток от каждого детектора (500-2400 штук) преобразуется в цифровой сигнал и после усиления подается в ЭВМ для обработки и хранения. Только после этого начинается собственно процесс восстановления изображения.
Восстановление изображения среза по сумме собранных проекций является чрезвычайно сложным процессом, и конечный результат представляет собой некую матрицу с относительными числами, соответствующую уровню поглощения каждой точки в отдельности.
В компьютерных томографах применяются матрицы первичного изображения 256 х 256, 320 х 320, 512 х 512 и 1024 х 1024 элементов. Качество изображения растет при увеличении числа детекторов, количества регистрируемых проекций за один оборот трубки и первичной матрицы. Увеличение количества регистрируемых проекций ведет к повышению лучевой нагрузки, применение большей первичной матрицы – к увеличению времени обработки среза или необходимости устанавливать дополнительные специальные процессоры видеоизображения.
Получение компьютерной томограммы (среза) головы на выбранном уровне основывается на выполнении таких операций, как:
1) формирование требуемой ширины рентгеновского луча (кол-лимирование);
2) сканирование головы пучком рентгеновского излучения, осуществляемого движением (вращательным и поступательным) вокруг неподвижной головы пациента устройства «излучатель – детекторы»;
3) измерение излучения и определение его ослабления с последующим преобразованием результатов в цифровую форму;
4) машинный (компьютерный) синтез томограммы по совокупности данных измерения, относящихся к выбранному слою;
5) построение изображения исследуемого слоя на экране видеомонитора (дисплея).
В системах компьютерных томографов сканирование и получение изображения происходят следующим образом. Рентгеновская трубка в режиме излучения «обходит» голову по дуге 240°, останавливаясь через каждые 3° этой дуги и делая продольное перемещение. На одной оси с рентгеновским излучателем закреплены детекторы – кристаллы йодистого натрия, преобразующие ионизирующее излучение в световое. Последнее попадает на фотоэлектронные умножители, превращающие эту видимую часть в электрические сигналы. Электрические сигналы подвергаются усилению, а затем преобразованию в цифры, которые вводят в ЭВМ. Рентгеновский луч, пройдя через среду поглощения, ослабляется пропорционально плотности тканей, встречающихся на его пути, и несет информацию о степени его ослабления в каждом положении сканирования. Интенсивность излучения во всех проекциях сравнивается с величиной сигнала, поступающего с контрольного детектора, регистрирующего исходную энергию излучения сразу же на выходе луча из рентгеновской трубки.
Следовательно, формирование показателей поглощения (ослабления) для каждой точки исследуемого слоя происходит после вычисления отношения величины сигнала на выходе рентгеновского излучателя к значению его после прохождения объекта исследования (коэффициенты поглощения).
В ЭВМ выполняются математическая реконструкция коэффициентов поглощения и пространственное их распределение на квадратной многоклеточной матрице, а полученные изображения передаются для визуальной оценки на экран дисплея.
За одно сканирование получают два соприкасающихся между собой среза толщиной 10 мм каждый. Картина среза восстанавливается на матрице размером 160 х 160 мм.
Полученные коэффициенты поглощения выражают в относительных единицах шкалы, нижняя граница которой (-1000 ед. Н.) (ед. Н. – единицы Хаунсфильда, или числа компьютерной томографии) соответствует ослаблению рентгеновских лучей в воздухе, верхняя (+1000 ед. Н.) – ослаблению в костях, а за ноль принимается коэффициент поглощения воды. Различные ткани мозга и жидкие среды имеют разные по величине коэффициенты поглощения. Например, коэффициент поглощения жира находится в пределах от -100 до 0 ед. Н., спинно-мозговой жидкости – от 2 до 16 ед. Н., крови – от 28 до 62 ед. Н. Это обеспечивает возможность получать на компьютерных томограммах изображение основных структур мозга и многих патологических процессов в них. Чувствительность системы в улавливании перепада рентгеновской плотности в обычном режиме исследования не превышает 5 ед. Н., что составляет 0,5 %.
На экране дисплея высоким значениям плотности (например, кости) соответствуют светлые участки, низким – темные. Градационная способность экрана составляет 15–16 полутоновых ступеней, различаемых человеческим глазом. На каждую ступень, таким образом, приходится около 130 ед. Н.
Для полной реализации высокой разрешающей способности томографа по плотности в аппарате предусмотрены средства управления так называемой шириной окна и его уровня (положения), чтобы дать рентгенологу возможность анализировать изображение на различных участках шкалы коэффициентов поглощения. Ширина окна – это величина разности наибольшего и наименьшего коэффициентов поглощения, соответствующая указанному перепаду яркости. Положение, или уровень, окна (центр окна) – это величина коэффициентов ослабления, равная середине окна и выбираемая из условий наилучшего выявления плотностей интересующей группы структур или тканей. Важнейшей характеристикой является качество получаемого изображения.
Известно, что качество визуализации анатомических образований головного мозга и очагов поражения зависит в основном от двух факторов: размера матрицы, на которой строится томограмма, и перепада показателей поглощения. Величина матрицы может оказывать существенное влияние на точность диагностики. Так, количество ошибочных диагнозов при анализе томограмм на матрице 80 х 80 клеток составляло 27 %, а при работе на матрице 160 х 160 уменьшилось до 11 %.
Компьютерный томограф обладает двумя видами разрешающей способности: пространственной и по перепаду плотности. Первый тип определяется размером клетки матрицы (обычно – 1,5 х 1,5 мм), второй равен 5 ед. Н. (0,5 %). В соответствии с этими характеристиками теоретически можно различать элементы изображения размером 1,5 х 1,5 мм. При перепаде плотности между ними не меньше 5 ед. Н. (1 %) удается выявлять очаги величиной не менее 6 х 6 мм, а при разнице в 30 ед. Н. (3 %) – детали размером 3 х 3 мм. Обычная рентгенография позволяет уловить минимальную разницу по плотности между соседними участками в 10–20 %. Однако при очень значительном перепаде плотностей рядом расположенных структур возникают специфические для данного метода условия, снижающие его разрешающую способность, так как при построении изображения в этих случаях происходит математическое усреднение, и при этом очаги небольших размеров могут быть не обнаружены. Чаще это происходит при небольших зонах пониженной плотности, расположенных вблизи массивных костных структур (пирамиды височных костей) или костей свода черепа. Важным условием для обеспечения проведения компьютерной томографии является неподвижное положение пациента, ибо движение во время исследования приводит к возникновению артефактов-наводок: полос темного цвета от образований с низким коэффициентом поглощения (воздух) и белых полос от структур с высоким КП (кость, металлические хирургические клипсы), что также снижает диагностические возможности.
Для получения более четкого изображения патологически измененных участков в головном мозге применяют эффект усиления контрастности, который достигается внутривенным введением рентгеноконтрастного вещества. Увеличение плотности изображения на компьютерной томограмме после внутривенного введения контрастного вещества объясняется внутри– и внесосудистыми компонентами. Внутрисосудистое усиление находится в прямой зависимости от содержания йода в циркулирующей крови. При этом увеличение концентрации на 100 мг йода в 100 мл обусловливает величины абсорбции на 26 ед. Н. При компьютерно-томографических измерениях венозных проб после введения 60 % контрастного вещества в дозе 1 мл на 1 кг массы тела плотность потока повышается в среднем в течение 10 мин после инъекции, составляет 39,2, ±9,8 ед. Н. Содержание контрастного вещества в протекающей крови изменяется в результате того, что относительно быстро начинается выделение его почками. Уже в течение первых 5 мин после болюсной инъекции концентрация вещества в крови в среднем снижается на 20 %, в последующие 5 мин – на 13 % и еще через 5 мин – на 5 %.


