
Коллектив авторов
Оперативные доступы в нейрохирургии. Том 1. Голова
АВТОРСКИЙ КОЛЛЕКТИВ
Алексеев Дмитрий Евгеньевич – врач-нейрохирург, адъюнкт кафедры нейрохирургии Военно-медицинской академии им. С. М. Кирова;
Бабичев Константин Николаевич – врач-нейрохирург клиники нейрохирургии Военно-медицинской академии им. С. М. Кирова;
Банников Сергей Александрович – врач-нейрохирург, старший ординатор клиники нейрохирургии Военно-медицинской академии им. С. М. Кирова;
Бараненко Юрий Михайлович – врач-анестезиолог-реаниматолог, заслуженный врач РФ, врач-анестезиолог клиники нейрохирургии Военно-медицинской академии им. С. М. Кирова;
Белов Игорь Юрьевич – врач-нейрохирург, аспирант ФГБУ «РНХИ им. проф. А. Л. Поленова» Минздрава России;
Гайворонский Алексей Иванович – доктор медицинских наук, доцент, преподаватель кафедры нейрохирургии Военно-медицинской академии им. С. М. Кирова, доцент кафедры морфологии Санкт-Петербургского государственного университета;
Гайворонский Иван Васильевич – доктор медицинских наук, профессор, заведующий кафедрой нормальной анатомии Военно-медицинской академии им. С. М. Кирова, заведующий кафедрой морфологии Санкт-Петербургского государственного университета, академик Военно-медицинской академии им. С. М. Кирова, заслуженный работник высшей школы РФ, дважды лауреат премии Правительства РФ в области образования, председатель Санкт-Петербургского отделения научного медицинского общества анатомов, гистологов и эмбриологов;
Гайдар Борис Всеволодович – академик РАН, академик Военно-медицинской академии им. С. М. Кирова, академик Российской медико-технической академии, академик Международной академии информатизации, доктор медицинских наук, профессор, генераллейтенант медицинской службы в отставке, заслуженный деятель науки РФ, вице-президент Ассоциации нейрохирургов РФ, член секции нейрохирургии Ученого медицинского совета Министерства здравоохранения, председатель специализированного ученого совета, член правления Санкт-Петербургской ассоциации нейрохирургов им. проф. И. С. Бабчина, профессор кафедры нейрохирургии Военно-медицинской академии им. С. М. Кирова, лауреат Государственной премии РФ и премии Правительства РФ;
Горбань Виталий Валерьевич – врач-челюстно-лицевой хирург, аспирант кафедры хирургической стоматологии и челюстно-лицевой хирургии ПСПбГМУ им. акад. И. П. Павлова;
Гуляев Дмитрий Александрович – доктор медицинских наук, руководитель отделения опухолей головного и спинного мозга № 2 ФГБУ «РНХИ им. проф. А. Л. Поленова» Минздрава России;
Закондырин Дмитрий Евгеньевич – кандидат медицинских наук, старший научный сотрудник научно-организационного отдела ФГБУ «РНХИ им. проф. А. Л. Поленова» Минздрава России;
Кондаков Евгений Николаевич – доктор медицинских наук, профессор, заместитель директора по организационно-методической работе ФГБУ «РНХИ им. проф. А. Л. Поленова» Минздрава России, лауреат Государственной премии РФ;
Ландик Сергей Александрович – кандидат медицинских наук, преподаватель кафедры нейрохирургии Военно-медицинской академии им. С. М. Кирова;
Лапшин Родион Анатольевич – кандидат медицинских наук, доцент кафедры нейрохирургии Военно-медицинской академии им. С. М. Кирова;
Маматханов Магомед Рамазанович – кандидат медицинских наук, старший научный сотрудник отделения нейрохирургии детского возраста ФГБУ «РНХИ им. проф. А. Л. Поленова» Минздрава России;
Мартынов Борис Владимирович – доктор медицинских наук, доцент, старший преподаватель кафедры нейрохирургии Военно-медицинской академии им. С. М. Кирова;
Назранов Руслан Хачимович – врач-нейрохирург, начальник нейрохирургического отделения Филиала № 3 ФГКУ «321 ВКГ» Министерства обороны РФ;
Низковолос Владимир Беневич – доктор технических наук, ведущий научный сотрудник Института мозга человека им. Н. П. Бехтеревой РАН;
Ничипорук Геннадий Иванович – кандидат медицинских наук, доцент кафедры морфологии медицинского факультета Санкт-Петербургского государственного университета, доцент кафедры нормальной анатомии Военно-медицинской академии им. С. М. Кирова, лауреат премии Правительства РФ в области образования;
Парфенов Валерий Евгеньевич – доктор медицинских наук, профессор, директор ГБУ НИИ СП им. И. И. Джанелидзе, генерал-майор медицинской службы запаса, лауреат Государственной премии РФ и премии Правительства РФ, заслуженный врач Российской Федерации, академик Военно-медицинской академии им. С. М. Кирова, член правления Ассоциации нейрохирургов РФ, член правления Санкт-Петербургской ассоциации нейрохирургов им. проф. И. С. Бабчина;
Полежаев Андрей Владимирович – кандидат медицинских наук, доцент, преподаватель кафедры нейрохирургии Военно-медицинской академии им. С. М. Кирова;
Преображенский Митрий Семенович – врач-нейрохирург;
Примак Никита Александрович – врач-нейрохирург, аспирант ФГБУ «РНХИ им. проф. А. Л. Поленова» Минздрава России;
Савелло Александр Викторович – доктор медицинских наук, профессор кафедры нейрохирургии Военно-медицинской академии им. С. М. Кирова;
Савчук Антон Николаевич – кандидат медицинских наук, преподаватель кафедры нейрохирургии Военно-медицинской академии им. С. М. Кирова;
Свистов Дмитрий Владимирович – кандидат медицинских наук, доцент, начальник кафедры нейрохирургии Военно-медицинской академии им. С. М. Кирова, Главный нейрохирург МО РФ, заслуженный врач РФ, лауреат Государственной премии РФ;
Холявин Андрей Иванович – доктор медицинских наук, старший научный сотрудник Института мозга человека им. Н. П. Бехтеревой РАН;
Чеботарев Сергей Яковлевич – кандидат медицинских наук, доцент кафедры хирургической стоматологии и челюстно-лицевой хирургии ПСПбГМУ им. акад. И. П. Павлова;
Черебилло Владислав Юрьевич – доктор медицинских наук, профессор, заместитель начальника кафедры нейрохирургии Военно-медицинской академии им. С. М. Кирова, заслуженный врач РФ;
Щеголев Алексей Валерианович – доктор медицинских наук, начальник кафедры анестезиологии и реаниматологии Военно-медицинской академии им. С. М. Кирова, Главный анестезиолог-реаниматолог МО РФ, Главный внештатный специалист по анестезиологии-реаниматологии Комитета по здравоохранению Санкт-Петербурга, заслуженный врач РФ;
Щербинин Антон Владимирович – кандидат медицинских наук, врач-нейрохирург Федерального медицинского исследовательского центра им. В. А. Алмазова.
УСЛОВНЫЕ СОКРАЩЕНИЯ
АВМ – артериовенозная мальформация
АД – артериальное давление
БА – базилярная артерия
ВГЩ – верхняя глазничная щель
ВМА – Военно-медицинская академия им. С. М. Кирова
ВПШ – вентрикулоперитонеальное шунтирование
ВСА – внутренняя сонная артерия
ВСС – верхний сагиттальный синус
ВЧГ – внутричерепная гипертензия
ВЧД – внутричерепное давление
ДВС – диссеминированное внутрисосудистое свертывание
ДТЧ – декомпрессивная трепанация черепа
ЗМА – задняя мозговая артерия
ЗНМА – задняя нижняя мозжечковая артерия
ЗЧЯ – задняя черепная ямка
ИВЛ – искусственная вентиляция легких
ИТТ – инфузионно-трансфузионная терапия
КТ – компьютерная томография
МК – мозговой кровоток
МРТ – магнитно-резонансная томография
МСКТ – мультиспиральная компьютерная томография
НГЩ – нижняя глазничная щель
НН – нейронавигация
ОРИТ – отделение реанимации и интенсивной терапии
ОФЭКТ – однофотонная эмиссионная компьютерная томография
ОЦК – объем циркулирующей крови
ПД – перфузионное давление
ПМА – передняя мозговая артерия
ПСоА – передняя соединительная артерия
ПЧЯ – передняя черепная ямка
ПЭТ – позитронно-эмиссионная томография
САК – субарахноидальное кровоизлияние
СМА – средняя мозговая артерия
СЧЯ – средняя черепная ямка
ТМО – твердая мозговая оболочка
УЗ – ультразвук
УЗДГ – ультразвуковая допплерография
УЗИ – ультразвуковое исследование
УС – ультрасонография
ХСО – хиазмально-селлярная область
ЦАГ – церебральная ангиография
ЦВД – центральное венозное давление
ЦК – цианоакрилатные клеи
ЦНС – центральная нервная система
ЦСЖ – цереброспинальная жидкость (ликвор)
ЧМТ – черепно-мозговая травма
ЧСС – частота сердечных сокращений
ЭКГ – электрокардиография
ЭхоЭС – эхоэнцефалоскопия
ЭЭГ – электроэнцефалография
ASA – Американская ассоциация анестезиологов
ПРЕДИСЛОВИЕ
Оперативным доступам в программе нейрохирургических вмешательств всегда уделялось особое внимание в связи с высокой их травматичностью, которая часто превышает травматичность оперативных приемов.
В настоящее время существуют хорошо иллюстрированные зарубежные атласы и руководства, посвященные описанию техники выполнения доступов к структурам черепа и головного мозга, которые заслуженно являются настольными книгами нейрохирургов. Однако в отечественной литературе аналогичных изданий за последние десятилетия не было. Издание данного руководства в известной мере может восполнить этот пробел.
В руководстве подробно описана техника выполнения различных доступов к структурам черепа и головного мозга с использованием современных хирургических технологий, техника закрытия операционной раны. Отдельная глава посвящена хирургической анатомии головы. Особое внимание уделено аппаратному оснащению нейрохирургической операционной и методике применения современных гемостатиков и имплантатов при операциях на голове.
Руководство предназначено для врачей, обучающихся по специальности «нейрохирургия», и практикующих нейрохирургов.
Заведующий кафедрой оперативной хирургии (с топографической анатомией) Военно-медицинской академии им. С. М. Кирова, заслуженный работник высшей школы РФ, доктор медицинских наук, профессор Н. Ф. Фомин
Глава 1
ХИРУРГИЧЕСКАЯ АГРЕССИЯ В ОКРУЖЕНИИ ФИЗИОЛОГИЧЕСКОЙ ДОЗВОЛЕННОСТИ
Оперативное вмешательство на центральной нервной системе (ЦНС), и в особенности на головном мозге, представляет собой действие изначально высокого риска, так как выполняется на органе, регулирующем функции организма в целом и обеспечивающем психическую деятельность человека.
К настоящему времени в нейрохирургии сформированы основные подходы к пониманию болезни поврежденного мозга, основанные на клинико-анатомических и патофизиологических закономерностях структурно-функциональных нарушений при различных заболеваниях и повреждениях ЦНС.
Системообразующая роль ЦНС в регуляции функций всех систем организма предопределяет вовлечение в развивающийся при повреждении или заболевании мозга процесс адаптационно-компенсаторных механизмов. В зависимости от локализации, характера (опухоль, сосудистые аномалии, травма, инсульт и т. д.) и течения патологического процесса (острый или хронический), а также напряженности компенсаторных механизмов (от компенсации до декомпенсации) привнесение дополнительных дисфункций системы углубляет поражение нервной ткани.
На органном уровне это определяется нарастанием внутричерепного давления (ВЧД) и увеличением недостаточности адаптации и компенсации в краниоспинальном пространстве. Повышение ВЧД вызывает отрицательное воздействие на головной мозг, углубляя его дисфункцию.
Повышение ВЧД инициирует каскад патофизиологических реакций, которые постепенно нарастают и начинают преобладать над саногенетическими процессами. Под воздействием повреждающих факторов как в очаге, так и на отдалении от него развиваются структурные нарушения, вплоть до апоптоза. Объем и характер вторичных повреждений в области патологического очага, смежных и отдаленных областях зависят от его локализации, патоморфологической структуры и времени существования.
В этих условиях необходимое хирургическое вмешательство и, в частности, оперативный доступ как дополнительная хирургическая агрессия должны отвечать основному требованию хирургии – минимизации операционной травмы. Из общих положений хирургии следует, что цель операции – устранить патологический очаг без ухудшения состояния пациента и появления дополнительных нарушений функций.
Оперативная нейрохирургия является одной из частных составляющих оперативной хирургии как «учения о хирургических операциях», т. е. раздела медицинской науки, а не простого собрания описаний различных оперативных приемов и доступов. Цель ее – не только изучить «технику производства той или иной операции, но и осмыслить ее производство». И, прежде всего, обосновать ее анатомически, выяснить топографические условия и особенности пространственных взаимоотношений, при которых «возможно или невозможно выполнить в данной области те или иные требования, предъявляемые хирургической клиникой». Основная задача оперативной хирургии состоит в том, что она «должна научить мыслить физиологически и оперировать анатомически» (Делицин С. Н., 1905).
Принципиальное значение и практическое применение в нейрохирургии имеют труды Н. Н. Бурденко и его школы в разработке методологии и техники оперативного доступа и самого нейрохирургического вмешательства. Основополагающий принцип оперативной нейрохирургии был сформулирован Н. Н. Бурденко в 1935 г.: «анатомическая доступность, техническая возможность и физиологическая дозволенность, наименьшая травматизация мозговой ткани и тщательнейший гемостаз».
Принципиальные установки и подробные научные разработки оперативных доступов, основанные на изучении анатомо-физиологических особенностей, получили дальнейшее развитие в работах школы А. Ю. Созон-Ярошевича.
К операционному доступу предъявляют два основных требования: наименьшая травматичность и обеспечение необходимого «простора» в ране, равно как и направление оси, которая определяет подход к «зоне интереса» – патологическому очагу. В правильных сочетаниях малой травматичности и максимальной доступности и кроется, в сущности, решение вопроса о доступах.
«Травматичность и доступность выступают как два враждующих между собой фактора, как две противоположности, объединенные единой задачей оперативного вмешательства… Одинаково необходимы и радикальное устранение болезненного процесса и минимальная травматичность операции. Несомненно, что в этом единстве двух противоречивых факторов ведущее значение принадлежит условиям доступа… при обязательном обеспечении второго фактора – минимальной травматичности» (Созон-Ярошевич А. Ю., 1954).
Эти основополагающие взаимоотношения единого оперативного воздействия справедливы для нейрохирургии и во многом определяют радикальность хирургического вмешательства и дальнейший процесс заживления послеоперационной раны.
Анатомическая доступность. Указанный постулат Н. Н. Бурденко в оперативной хирургии может быть определен как доступность объекта операции, которая характеризуется направлением оси операционного действия, глубиной раны, углом операционного действия, углом наклона оси операционного действия, зоной доступности.
Ось операционного действия – линия, соединяющая глаз хирурга с наиболее глубокой точкой операционной раны. Значение направления оси операционного действия при выборе операционного доступа велико, так как от этого зависит, как будет видеть хирург объект операции, какие ткани и анатомические образования он должен пройти, чтобы достичь «объекта». Направление оси операционного действия создает основные качества, характеризующие доступ к глубоко расположенным объектам – от исходной точки разреза до того момента, когда хирург увидит объект.
Глубина раны. Значение глубины раны определяется тем, что она обеспечивает большую или меньшую свободу манипуляций хирурга и предъявляет требования к длине рабочей части инструмента.
Угол операционного действия образован и ограничен стенками конуса операционной раны. Значение его определяется возможностью, наряду с глубиной раны, перемещения в ней инструментов (рис. 1), требованиями к их форме, углам между осями рукоятки и рабочей части.
Угол наклона оси операционного действия образован осью операционного действия и плоскостью поверхности раны. Значение его состоит в том, что им определяется угол, под которым хирург обозревает объект операции (рис. 2).
Зона доступности – дно раневой полости. Является одним из важных показателей; в зависимости от глубины раны и размеров раневой полости степень доступа к объекту хирургического интереса может быть различна.
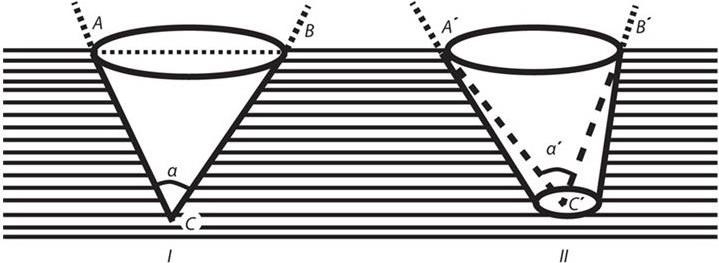
Рис. 1. Схема измерения угла операционного действия при разных формах раневой полости (Созон-Ярошевич А. Ю., 1954):
I, II – варианты формы операционной раны; АCB, А'C'B' – стенки конуса операционной раны; α, α' – углы наклона операционного действия
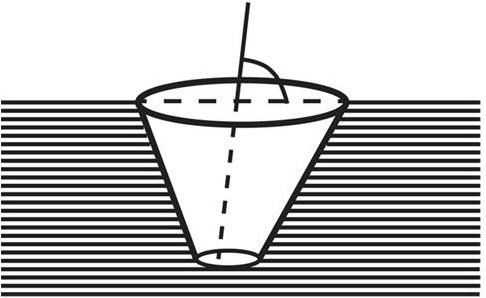
Рис. 2. Схема определения угла наклона оси операционного действия (Созон-Ярошевич А. Ю., 1954)
Сравнение этих показателей, без сомнения, важно при разработке новых или совершенствовании известных оперативных доступов, усовершенствовании микрохирургического инструментария.
Указанные характеристики операционного доступа позволяют оценить пространственные отношения в ране, провести сравнительный морфометрический анализ различных доступов и сделать соответствующий выбор.
Возможности современной оперативной нейрохирургии, методологией которой является микронейрохирургия, позволяют оптимизировать ось операционного действия и глубину раны. Это обусловлено тем, что большинство хирургических вмешательств на глубоких отделах головного мозга и основания черепа осуществляется под операционным микроскопом или с использованием эндоскопа, с помощью микроинструментария. Оптическая ось микроскопа или тубуса эндоскопа, совпадая с осью операционного действия, является определяющей характеристикой, а имеющееся в приборе освещение и набор микроинструментов позволяют хирургу манипулировать в ране и на значительной глубине.
Травматичность операционного доступа. Современный этап развития оперативной нейрохирургии позволяет считать, что техническая возможность выполнения операции и наименьшая травматизация мягких тканей головы, костей черепа и мозговой ткани являются понятиями одной сути.
Современная оперативная нейрохирургия располагает значительным объемом сведений по топографической нейрохирургической анатомии. С использованием новейших технических и методических разработок в общей патологии и анатомии созданы специальные подробные атласы топографии структур и функций головного мозга, в том числе и виртуальные. Кроме того, широкое внедрение в диагностический процесс компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ), позволяющих получить пространственное изображение структур мозга и патологического очага, обеспечивает проведение предоперационного моделирования хирургического вмешательства. Они позволяют выбрать наиболее оптимальный, менее травматичный операционный доступ. Для уменьшения травматичности доступа и самой операции в микронейрохирургии широко используются естественные щели, борозды и ликворные пространства головного и спинного мозга.
Развитие и внедрение микронейрохирургии способствовало отказу от использования широкой трепанации черепа, значительного рассечения твердой мозговой оболочки, продолжительной тракции долей мозга и других приемов, ранее считавшихся классическими.
Использование во время операции стереотаксического наведения, ультразвуковой эхолокации, функционального картирования, флюоресцентной диагностики позволяет с наименьшими повреждениями ткани мозга локализовать патологический очаг и обеспечить к нему подход. Электрофизиологический нейромониторинг позволяет уточнить локализацию функционально значимых структур мозга и тем самым предупредить стойкие неврологические нарушения.
Здесь можно вспомнить озабоченность Н. Н. Бурденко, который говорил: «…что же касается основного момента нейрологической диагностики locus morbi, то мы не можем не сознаться, что попытка ставить диагностику по полям Бродмана оказалась применимой только к ограниченному числу болезненных форм. Выражаясь фигурально, мы довольствуемся в диагностической картине фресками, но отказываемся от долгожданного портрета».
Современная нейрохирургия, обладая целым арсеналом технологических возможностей и средств, используемых для определения locus morbi, позволяет уже с большой уверенностью считать, что «портрет болезни» вырисовывается.
Несомненно, важным и, к сожалению, нередко неизбежным элементом многих хирургических доступов является необходимость той или иной степени тракции мозга. Продолжительность и выраженность сдавления структур мозга шпателями при тракции определяют повреждения ткани: ишемию, отек, кровоизлияния различной глубины и распространенности, а в дальнейшем – неврологические нарушения, расстройства когнитивных функций.
Травматичность тракции значительно снизилась благодаря использованию автоматических самофиксирующихся шпателей-ранорасширителей различных конструкций, атравматичных шпателей с силиконовым элементом, снижающим удельное давление. Но главным является отказ от постоянной тракции вовсе или краткосрочное ее использование на конкретных этапах вмешательства с периодами «декомпресии» краев мозговой раны или долей мозга. Современные технические разработки приборов и инструментов для биполярной коагуляции, ультразвуковой дезинтеграции, регулируемой аспирации также способствуют значительному уменьшению травматичности хирургического вмешательства на головном мозге.
Физиологическая дозволенность. Значительные успехи анестезиологии и выделение нейрохирургии в самостоятельную специальность способствовали формированию нового раздела общей анестезиологии – нейроанестезиологии.
Современное анестезиологическое обеспечение нейрохирургических операций позволяет проводить оперативные вмешательства высокой сложности на головном и спинном мозге и при необходимости большой продолжительности.
Используемые в нейроанестезиологии схемы анестезии не оказывают отрицательного эффекта на основные показатели краниоспинальной системы: мозговой кровоток, метаболизм мозга, ВЧД и циркуляцию спинномозговой жидкости, биоэлектрическую активность мозга.
Как известно, мозг лишен болевых рецепторов. Болевые нервные окончания имеются лишь в стенках крупных сосудов и твердой мозговой оболочке. В то же время мягкие ткани головы, кости черепа и твердая мозговая оболочка содержат большое число болевых рецепторов. В связи с этим первые этапы нейрохирургической операции являются наиболее травматичными и болезненными – разрез мягких тканей, трепанация черепа и рассечение твердой мозговой оболочки. На этих этапах уровень антиноцицептивной защиты является максимальным, а с целью аналгезии дополнительно должна выполняться местная анестезия (начиная с этапа установки скобы головодержателя).
Многофакторное воздействие на головной мозг во время нейрохирургической операции сопровождается появлением специфических реакций организма – центрогенных или укороченных рефлексов.
Обязательное проведение во время нейрохирургических вмешательств мультимодального физиологического мониторинга, включающего основные параметры оценки гемодинамики, дыхания, метаболизма, изменений биоэлектрической активности и вызванных потенциалов, позволяет контролировать реакции на хирургические манипуляции. При возникновении реакций артериального давления (АД), частоты сердечных сокращений (ЧСС), сердечного ритма, электроэнцефалографии (ЭЭГ), связанных с раздражением локальных центров мозга или ядер черепных нервов, манипуляции хирурга должны быть приостановлены или прекращены. По мере восстановления физиологических показателей должна быть изменена тактика вмешательства или операция должна быть разделена на этапы.
Таким образом, современные возможности интраоперационного контроля и нейромониторинга позволяют предотвратить возникновение и усугубление физиологических нарушений, а значит, обеспечить физиологическую дозволенность хирургических манипуляций в области различных анатомо-функциональных образований мозга.
Расширение оперативных возможностей нейрохирургии позволяет хирургу проводить высокотехнологичные операции в ранее недоступных анатомических областях краниоспинальной системы. При выполнении этих вмешательств, особенно в области ствола головного мозга, понятие «физиологической дозволенности» становится первым в ряду показателей «тревоги», приобретя не только качественные, но и количественные оценки, обеспеченные современным нейромониторингом.
Тщательный гемостаз. «Трудность остановки кровотечений долгое время была причиной тяжелых исходов после операций ввиду своеобразного строения сосудов мозга и невозможности пользоваться обычными кровоостанавливающими инструментами… Остановка кровотечения делается клипсами или электрокоагуляцией». На протяжении многих лет, пожалуй, единственным способом остановки капиллярного кровотечения в ране мозга являлось использование ватных полосок, ватников, пропитанных 3 % раствором перекиси водорода, и электрокоагуляции. В таких условиях период гемостаза в ране был достаточно продолжительным и случаи послеоперационных кровотечений были нередки.
Сегодня существует два основных мнения о причинах и механизмах влияния оперативного вмешательства на систему регуляции агрегатного состояния крови:
– гиперкоагуляция и повышение фибринолитической активности в ходе операции связаны с универсальными механизмами реализации стрессовых реакций;
– нарушения гемокоагуляции во время операции связаны с синдромом диссеминированного внутрисосудистого свертывания (ДВС), развитие которого обусловлено травматичностью оперативного вмешательства и определяется тромбопластинемией из операционной раны.
Взаимодействие общей гемостатической реакции организма и локального гемостаза в операционной ране проявляется в реакциях противосвертывающего звена системы коагуляции.
На основании этих положений очевидно, что профилактика и коррекция нарушений гемокоагуляции в ходе операций должны строиться на принципах профилактики и лечения ранних стадий ДВС. Общие мероприятия по профилактике синдрома ДВС направлены на обеспечение достаточного уровня в крови факторов свертывания и адекватных условий микроциркуляции, а местные (в ране мозга) – на остановку и профилактику повторных кровотечений.
Сочетание общих и местных воздействий позволяет добиться обеспечения надежного гемостаза в операционной ране, получить «сухое» операционное поле, что особенно важно при использовании микрохирургической техники. Кроме того, сегодняшний арсенал средств для гемостаза в операционной ране достаточно широк и позволяет эффективно осуществлять этот важный этап хирургического вмешательства.
Таким образом, говоря об «открытых» нейрохирургических вмешательствах, можно считать, что хирургическая агрессия, вооруженная современным инструментарием, оборудованием и средствами, является не столь травматичной, как раньше. Тем не менее основным фактором, определяющим и ограничивающим объем и радикальность хирургического вмешательства, при учете всех перечисленных обязательных составляющих современной микронейрохирургии, является физиологическая дозволенность.
Так, например, анатомическая доступность целого ряда зон основания черепа стала возможной благодаря применению и постепенному совершенствованию так называемых skull base-технологий, основанных на резекции и временной мобилизации костных структур основания черепа, магистральных сосудов и черепных нервов, расслоении листков твердой мозговой оболочки. В послеоперационном периоде в мозговой ране происходят различные по значимости и патогенетической сущности процессы. Совершенно очевидно, что при меньшем сопутствующем повреждении здоровых тканей, происходящем во время операции, быстрее проходит процесс заживления, более полноценным является восстановление пациента. При этом повреждение более древних в филогенетическом плане тканей и структур переносится организмом легче, чем сформировавшихся позднее, что обусловлено различными возможностями компенсации нарушенных функций на фоне регенерации и мощными механизмами саногенеза. Именно этим обстоятельством продиктовано использование базальных хирургических доступов, обеспечивающих наименьшую травматизацию тканей мозга.
Использование хирургической оптики, и прежде всего операционных микроскопа и эндоскопа, дало возможность детального осмотра глубинных отделов головного мозга в условиях достаточного освещения даже при значительной глубине раны (рис. 3, см. цв. вклейку). Технический прогресс и модернизация хирургического инструментария обусловили совершенствование микрохирургической техники и предопределили формирование философии минимально инвазивной хирургии как основы физиологической дозволенности нейрохирургических манипуляций. Логическим развитием этой хирургической философии стала нейроэндоскопия, занявшая прочное место в таких разделах, как трансбазальная хирургия опухолей основания черепа, хирургия водянки, внутрижелудочковых новообразований, арахноидальных кист и др. Кроме того, нейроэндоскопия нашла широкое применение как ассистирующая хирургическая манипуляция, позволяющая обеспечить более полный осмотр и иллюминацию операционной раны, особенно щелевидной и глубокой.
Однако применение принципов «быстрой хирургии», обусловливающих снижение сроков госпитализации, должно быть строго регламентировано, чтобы минимально инвазивные операции не стали минимально полезными для пациента. Соблюдение принципов абластики и максимальной циторедукции не должно нарушаться в стремлении врача снизить хирургическую агрессию. В ряде случаев адекватное хирургическое вмешательство может дать длительную ремиссию заболевания с хорошим уровнем социальной реадаптации, не переводя болезнь в хроническое или ремиттирующее течение, при котором пациент подвергается повторным операциям и курсам с применением адъювантных методов терапии, часто малоэффективных.
При выборе хирургического доступа следует принимать во внимание не только топографо-анатомические варианты и биологические особенности опухоли, но и основополагающие принципы общей онкологии.
Таким образом, современная хирургия опухолей основания черепа и мозга формирует дилемму:
– с одной стороны, абсолютно необоснованно выполнять обширные, длительные, весьма травматичные доступы, итогом которых нередко является лишь биопсия новообразования;
– с другой стороны, радикальная хирургия базальных опухолей на современном этапе невозможна без применения различных по локализации и объему резекций структур основания черепа с целью защиты мозга от хирургической агрессии.
Основной целью хирургического вмешательства по-прежнему является выполнение оптимального хирургического приема при условии снижения риска или исключения послеоперационных осложнений. Адекватным хирургическим доступом, в частности хирургии базальных структур, является не только оптимально широкий подход, обеспечивающий надежный осмотр необходимых анатомических ориентиров за счет удовлетворительной геометрии раны, но и обусловливающий достаточную физиологическую безопасность окружающих мозговых, сосудистых и невральных структур.


