
Коллектив авторов
Молекулярная морфология. Методы флуоресцентной и конфокальной лазерной микроскопии
УСЛОВНЫЕ СОКРАЩЕНИЯ
АТ-пара – пара нуклеотидов аденин – тимин
АТФаза – аденозинтрифосфатаза
ГАМК – гамма-аминомасляная кислота
ГДК – глутаматдекарбоксилаза
ГЦ-пара – пара нуклеотидов гуанин – цитозин
дцДНК – двухцепочечная
ДНК ММ – молекулярная масса
НК – нуклеиновые кислоты
оцДНК – одноцепочечная
ДНК ПЦР – полимеразная цепная реакция
РНК – рибонуклеиновая кислота
СФ – синаптофизин
ФСБ – фосфатно-солевой буфер
ФЭУ – фотоэлектронный умножитель
ЦПМ – цитоплазматическая мембрана
ЭПР – эндоплазматический ретикулум
ЭФР – эпидермальный фактор роста
5-TAMRA – 5-carboxytetramethylrhodamine
CCD-матрица (ПЗС-матрица) – charge-coupled device (прибор с зарядовой связью)
DABCO – диазобициклооктан
DAPI – 4,6-диамидино-2-фенилиндол
DMD – digital micromirror device (цифровые микрозеркальные устройства)
EB – этидия бромид
FITC – флуоресцеинизотиоцианат
FLAP – Fluorescence Localization After Photobleaching (локализация флуоресценции после фотоотбеливания)
FLIM – fluorescence lifetime imaging microscopy (микроскопия для исследования времени жизни флуоресценции)
FLIP – Fluorescence Lossin Photobleaching (потеря флуоресценции во время фотоотбеливания)
FRAP – Fluorescence Recovery After Photobleachin (восстановление флуоресценции после фотоотбеливания)
FRET – Fдrster (Fluorescence) Resonance Energy Transfer (Фёрстеровская (флуоресцентная) резонансная передача энергии)
GPDH – глицерофосфатдегидрогеназа
LDH – лактатдегидрогеназа
PBFI – potassium-binding benzofuran isophtalate
PPI – пропидия йодид
PPDA – парафенилендиамин
RITC – родаминизотиоцианат
SBFI – sodium-binding benzofuran isophtalate
SDS – додецилсульфат натрия
SHIM – Second-harmonic imaging microscopy (микроскопия с использованием регистрации второй гармоники)
SNAP25 – Sy Naptosomal-Associated Protein, 25 kD
SNARE – Soluble N-ethylmaleimide-sensitive factor Attachment protein Receptor
TRITC – тетраметилродамин-5(6) – изотиоцианат
ПРЕДИСЛОВИЕ
В последние годы благодаря достижениям квантовой физики, молекулярной биологии и иммуноцитохимии, классические морфологические дисциплины приобрели совершенный инструмент для молекулярного анализа клеточных и тканевых структур. Сейчас можно констатировать, что на основе всестороннего использования новых молекулярных подходов происходит выделение передового направления в морфологии – молекулярной морфологии. Молекулярная морфология, аккумулируя знания, накопленные классической гистологией, эмбриологией, и патологической анатомией, способна занять ключевое место в интеграции клеточной биологии, биохимии, физиологии, молекулярной генетики и протеомики при решении фундаментальных проблем и прикладных задач биомедицинских исследований. Молекулярная морфология, используя постоянно расширяющиеся возможности новых методов конфокальной микроскопии, а также оптической микроскопии сверхвысокого разрешения, в скором времени должна решить насущную задачу создания нового поколения методов трехмерного молекулярного анализа клеточных и тканевых структур, пригодных для использования не только в практике научного исследования, но и в диагностических целях. Ожидаемые новые методы должны быть просты, надежны в использовании, высокоселективны и высокочувствительны. Успешное решение поставленной задачи требует от исследователя глубоких знаний о современных методических приемах иммуноцитохимии, флуоресцентной и конфокальной лазерной микроскопии. Одной из важных задач, стоящих перед морфологом, занимающимся научными исследованиями, является участие в комплексных исследовательских программах, объединяющих специалистов разного профиля с целью решения конкретной научной проблемы. Квалифицированному специалисту-морфологу для успешного выполнения задач комплексных междисциплинарных исследований уже недостаточно владения только основами общей, частной морфологии и патологии, но требуется также и понимание главных биофизических принципов, лежащих в основе феноменов, используемых при создании приборов, предназначенных для флуоресцентной и конфокальной лазерной микроскопии. Без этого невозможно разобраться в сложных настройках современных приборов, от правильного использования которых зависит окончательный результат кропотливой подготовительной работы. Облегчить специалистам-морфологам и научным работникам смежных специальностей знакомство с новыми методами микроскопии и показать, как можно с их помощью решать различные задачи, связанные с изучением структур клеток и тканей, должна помочь настоящая книга.
Технической базой для реализации представленных в приложениях протоколов и иллюстраций, помещенных на вклейках, послужил комплекс оборудования и программного обеспечения, разработанный фирмой Zeiss (Германия), который включает конфокальные лазерные микроскопы LSM 710 и LSM 510 Meta. Иммуноцитохимические протоколы и общие принципы работы с конфокальным микроскопом универсальны и могут успешно использоваться с оборудованием любых производителей.
Настоящее руководство аккумулирует многолетний опыт сотрудников лаборатории функциональной морфологии центральной и периферической нервной системы отдела общей и частной морфологии Института экспериментальной медицины, связанный с использованием методов конфокальной лазерной микроскопии и иммуноцитохимии.
Научные исследования, результаты которых использованы при написании этой книги, были выполнены при поддержке Российского научного фонда (проект № 14-15-00014).
Д. Э. Коржевский
Глава 1.
ФЛУОРЕСЦЕНТНАЯ МИКРОСКОПИЯ И КОНФОКАЛЬНАЯ ЛАЗЕРНАЯ МИКРОСКОПИЯ – ПРИНЦИПЫ И ОСНОВНЫЕ МЕТОДЫ
Большинство биологических объектов обладают низким контрастом внутренних структур, которые в основном прозрачны, поэтому возможности их наблюдения методом классической микроскопии светлого поля ограничены. Эта проблема может быть преодолена несколькими путями: применением метода исследования в темном поле, использованием метода фазового контраста, для двулучепреломляющих материалов применяют поляризационный контраст. Основным же методом контрастирования в биологии является окрашивание препаратов веществами, способными связываться с препаратом и поглощать свет или флуоресцировать. Последние называют флуорохромами.
1.1. Основные понятия
Флуорохромы (флуоресцентные красители)1 – это вещества, которые способны связываться с объектом и расходовать часть энергии поглощенного света на флуоресценцию. Под флуоресценцией понимают способность ряда веществ после поглощения света с одной длиной волны излучать свет с другой длиной волны. Напомним, что электроны в атомах расположены на энергетических уровнях; расстояние между уровнями является характеристикой молекулы. При облучении вещества светом возможен переход электронов на более высокий энергетический уровень. Разница энергии между энергетическими уровнями и частота колебаний поглощенного света связаны между собой уравнением Бора (постулат Бора):
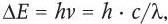
где ΔЕ – разность энергий между уровнями; v – частота; λ – длина волны; h – постоянная Планка; с – скорость света.
После поглощения света часть полученной системой энергии расходуется в виде тепла, а часть может быть излучена в виде фотона. Согласно правилу Стокса, длина волны испускаемого света больше, чем длина волны поглощаемого, или, другими словами, максимум спектра излучения сдвинут по отношению к максимуму спектра поглощения в сторону более длинных волн. С физическими основами описанных выше процессов более подробно можно ознакомиться в учебнике Р. Фейнмана (2011).
Каждый флуорохром характеризуется определенным спектром поглощения и испускания. Например, один из самых распространенных флуоресцентных красителей – FITC (fluorescein-5-isothiocyanate) – имеет максимум поглощения lex = 492 нм, а максимум излучения для него составляет lem = 518 нм. Другой распространенный флуорохром, 5-TAMRA (5-carboxytetramethylrhodamine), имеет lex = 543 нм и lem = 570 нм. На величину стоксова сдвига также влияет полярность среды, в которой находится флуорохром.
Наиболее интенсивной флуоресценции флуорохрома можно добиться, облучая его светом с длиной волны, близкой к максимуму поглощения, однако возможно перевести флуорофор в возбужденное состояние и при облучении его светом с длиной волны, существенно отличающейся от его максимума поглощения. Например, флуорофор можно перевести в возбужденное состояние двумя или тремя длинноволновыми фотонами (мультифотонное возбуждение), что будет эквивалентно возбуждению одним коротковолновым фотоном. Так, возбуждение двумя или тремя фотонами с длиной волны 900 нм эквивалентно возбуждению одним фотоном с длиной волны 450 или 300 нм.
Еще одной характеристикой флуорохрома является квантовый выход – отношение интенсивности поглощаемого и испускаемого света. Квантовый выход (Q) может быть выражен через отношение интенсивности флуоресценции (F) к разности интенсивностей падающего (I0) и выходящего (I) световых потоков:
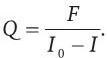
Заметим, что квантовый выход всегда меньше единицы из-за «стоксовских» потерь. В зависимости от квантового выхода флуорохромы разделяют на слабые и сильные. Современные синтетические флуорохромы, как правило, обладают высоким квантовым выходом и являются сильными.
Для характеристики способности флуорохрома поглощать свет определенной длины волны вводят понятие молярного коэффициента экстинкции, который определяется как оптическая плотность одномолярного раствора вещества при толщине светопоглощающе-
го слоя в 1 см. Молярный коэффициент поглощения имеет размерность л ⋅ моль-1⋅ см -1. Он зависит от природы вещества и от длины волны проходящего света. Величина, полученная путем перемножения молярного коэффициента экстинкции на величину квантового выхода, характеризует яркость флуоресценции флуорохрома при заданной длине волны. Время облучения, при котором флуорохром теряет 50 % яркости, называют фотостабильностью. «Идеальный» флуорохром должен иметь высокий квантовый выход и хорошую фотостабильность. Современные флуорохромы на основе полупроводниковых нанокристаллов (квантовых точек) по этим показателям на порядок превосходят органические соединения (Олейников В. А., 2011).
Еще один важный параметр — время жизни возбужденного состояния, которое определяется как среднее время нахождения молекулы в возбужденном состоянии до того, как вернуться в основное состояние. Время затухания флуоресценции флуорохрома (τ) описывается формулой:
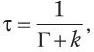
где Г – константа скорости излучательной дезактивации флуорофора; k – обобщенная константа скорости безызлучательной дезактивации.
Обычно время затухания флуоресценции составляет около 10 нс.
Тушением флуоресценции называют любые процессы, которые уменьшают интенсивность флуоресценции данного вещества. К тушению может приводить множество процессов: химические реакции в возбужденном состоянии, перенос энергии, образование комплексов, тушение при столкновениях. К тушению флуоресценции относятся также процессы кажущегося тушения, которое обусловлено оптическими свойствами образца (высокая оптическая плотность, мутность). Для тушения флуоресценции требуется контакт между молекулами флуорохрома и тушителя. Если тушитель диффундирует к флуорохрому, пока последний находится в возбужденном состоянии, и в результате контакта флуорохром возвращается в основное состояние без излучения фотона, говорят о динамическом тушении. Статическое тушение происходит при образовании нефлуоресцирующего комплекса между флуорохромом и тушителем. При увеличении концентрации флуорохрома возможно самотушение флуоресценции как результат поглощения молекулами вещества собственного излучения. Возможно также поглощение флуоресцентного излучения одного флуорохрома другим. К тушителям флуоресценции относят молекулярный кислород, ароматические и алифатические амины, ксенон, пероксид водорода, акриламид, оксид азота, нитрометан, нитроксиды, хлороформ, трихлорэтанол, бромбензол. Следует отметить, что не все флуорохромы тушатся любыми из вышеперечисленных веществ, однако (в зависимости от условий эксперимента) почти всегда можно подобрать эффективную пару флуорохром-тушитель или, напротив, избежать тушения флуоресценции (что более важно в морфологических исследованиях).
Для флуорохромов характерна анизотропия флуоресценции. Анизотропия – это зависимость свойств вещества от направления. При возбуждении поляризованным светом селективно возбуждаются только те молекулы флуорохрома, для которых дипольный момент перехода при поглощении параллелен электрическому вектору возбуждающего излучения. Такое селективное возбуждение частично ориентированного набора флуорохромов приводит к частично поляризованному испусканию флуоресценции. В общем случае анизотропия флуоресценции r выражается формулой:
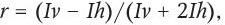
где Iv и Ih – интенсивности флуоресценции вертикально и горизонтально поляризованного испускания в случае возбуждения образца вертикально поляризованным светом.
При планировании экспериментов с использованием флуорохромов, особенно флуорохромов нового поколения – квантовых точек – необходимо учитывать возможность мерцания флуоресценции. Это стохастический процесс перехода флуорохрома из флуоресцирующего состояния в состояние отсутствия флуоресценции, несмотря на постоянное возбуждение. В результате, при наблюдении за одиночными флуоресцирующими комплексами возникает стробоскопический эффект (зрительная иллюзия неподвижности или мнимого движения предмета при его прерывистом наблюдении). Кроме этого, поскольку время нахождения флуорохрома во «включенном» и «выключенном» состоянии является случайным, сравнение результатов независимых экспериментов при использовании таких флуорохромов затруднено. При конфокальной микроскопии данный эффект может быть компенсирован за счет линейного или покадрового усреднения сканируемых изображений.


