
Ирина Ле-Дейген
Просто о ферментах. Почему они так полезны?
Код питания

© И. М. Ле-Дейген, текст, иллюстрации, 2024.
© Н. Л. Клячко, текст, 2024.
© ООО «Издательство АСТ», оформление, 2024.
Введение
Представьте свой любимый завтрак. Что это будет за блюдо? Сырники с тонкой румяной корочкой, со сметаной и ягодами? А может быть, тот самый знаменитый авокадо-тост на подсушенном цельнозерновом хлебе с творожным сыром? Черный чай и круассан?
Представили? Извините, если ощутили желание перекусить. Пока ваш мозг создавал картинку аппетитной еды, представлял всю гамму ароматов и вкусов, ваш желудок уже начал готовиться к процессу пищеварения. Выделился желудочный сок, который был назван Нобелевским лауреатом И. П. Павловым «запальным» соком. Эта стадия пищеварения, когда еда еще даже не попала в рот, называется цефалической (от греч. κεφάλι – голова).
Так вот, если бы вы сейчас после визуализации все же решили съесть этот самый завтрак, в дело вступили бы следующие стадии пищеварения. Цель их – изъять из еды как можно больше всего полезного и нужного для функционирования и развития организма. Для этого во рту, в желудке и в кишечнике действуют десятки крохотных машин, которые в совершенстве исполняют каждый свою важную задачку. Эти машины называются ферменты, и они представляют собой большие молекулы – белки.
Но что, если окажется, что ферменты помогают не только переваривать пищу, но и производить ее? И сырники, и хлеб, и творожный сыр – и даже чай – все это создано с помощью ферментов.
С химической точки зрения вся еда есть не что иное, как набор очень разных молекул, соединившихся воедино благодаря природе (как например жиры и белки – в твороге) или человеку, когда мы добавили к творогу ягоды.
Для того чтобы разобраться с тем, как работают ферменты в пищеварении и для пищеварения, предлагаем сначала познакомиться с этими самыми молекулами. Разобравшись, что из себя представляют основные молекулы в пище, мы научимся ими управлять с помощью ферментов.
Глава 1
Важные биомолекулы
Атомы и элементы
Давайте немного вспомним школьный курс химии. Привычный нам материальный мир состоит из атомов – мельчайших частиц. Представьте себе, что атомы – это автомобили на улице, их несчетное количество! А вот моделей автомобилей – ограниченное количество. Есть огромные «Бентли Континенталь» и крошечные «Дэу Матиз». С атомами все то же самое. Их бессчетное количество в мире, но вот видов атомов на 2023 год было описано всего 118. Есть атомы-крошки, и есть атомы-гиганты. Виды атомов называются химическими элементами, и именно эти элементы собраны в Периодическую таблицу Д. И. Менделеева. Так, самый маленький атом – это водород (H) с атомной массой, принятой за единицу, а самый большой на данный момент атом оганесона (Og) в своей наиболее устойчивой форме имеет массу 294, то есть он почти в 300 раз тяжелее водорода!
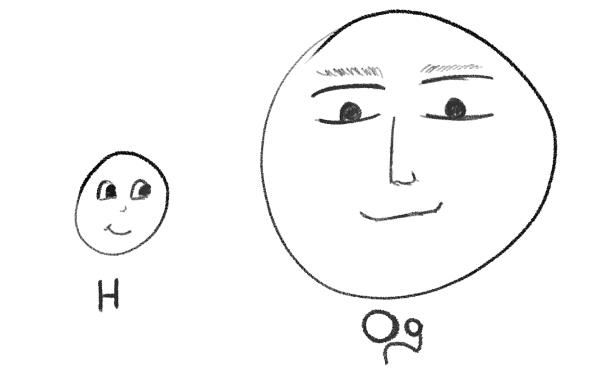
Рисунок 1. Самый маленький – атом водорода и самый большой на 2023 год – атом оганесона
Что будет, если в одном месте соберется много автомобилей? Как минимум пробка, а то и ДТП. В отличие от железных коней атомы способны к продуктивной совместной деятельности. Образуя химические связи, атомы объединяются в молекулы. Например, молекула воды состоит всего лишь из 3 атомов – двух водорода и одного кислорода (H2O), в то время как молекула сахарозы (самый обычный пищевой сахар) состоит уже из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода (С12Н22О11). Но это не идет ни в какое сравнение с так называемыми биополимерами – исполинскими молекулами, благодаря которым существует жизнь, например ДНК. Там счет идет на сотни миллионов атомов. Справедливости ради надо отметить, что далеко не все вещества имеют молекулярную структуру. Например, та же поваренная соль – хлорид натрия (NaCl), хоть и состоит всего из двух элементов, имеет кристаллическую структуру, в который атомы упорядоченно стоят каждый на своем месте в так называемых углах кристаллической решетки. Практически совершенным примером кристалла можно считать и алмаз, состоящий только лишь из углерода. Если же в алмазе появляются атомы других элементов, например бора, получаются исключительно редкие цветные камни (в случае с бором после огранки получаются голубые бриллианты, и их всего 0,02 % от мировой добычи).
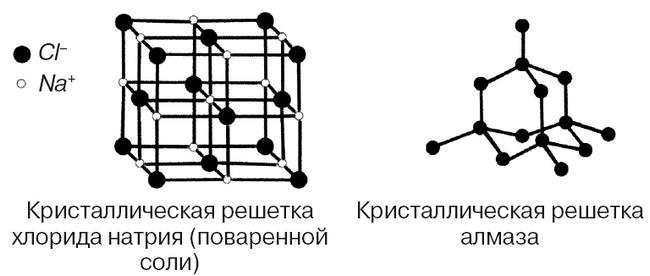
Рисунок 2. Схемы кристаллической решетки хлорида натрия и алмаза
Среди всех элементов в живых системах выделяют макроэлементы, которые, как атланты, держат на плечах весь груз функционирования биологических молекул (это углерод – С, водород – H, азот – N, кислород – O) и микроэлементы, которых значительно меньше, если сравнивать в «штуках», но роль их так же важна (это фосфор – F, кальций – Ca, сера – S, йод – I, селен – Se и т. д.).
Для существования жизни и для того, чтобы организмы могли расти, развиваться и размножаться, эволюция создала несколько классов биологических молекул. К этим классам относятся белки, жиры, углеводы и нуклеиновые кислоты. Первые три класса вам могут быть знакомы как основные нутриенты, и диетологи призывают следить за тем самым балансом БЖУ.
С точки зрения химии внутри каждого класса биологических молекул присутствуют единство структуры. Оставив в стороне нуклеиновые кислоты (это все-таки в поле интересов генетики), познакомимся с каждым из классов по отдельности. Но для полной картины узнаем еще об одной очень интересной и гораздо более разрозненной по структуре группе веществ – витаминах. Но для полной картины познакомимся еще с одной очень интересной и гораздо более разрозненной по структуре группой веществ – витаминами. Они нам очень пригодятся, когда дальше будем обсуждать непосредственно ферменты.
Белки
Философы прошлого говорили, что жизнь – это форма существования белковых тел. Правы они или нет, судить не нам. Лучше перенесемся на зарю зарождения жизни на Земле. Около 4 миллиардов лет назад на очень еще юной планете (тогда ей было всего-то полмиллиарда лет) стали появляться первые биомолекулы. Что было раньше – белки или нуклеиновые кислоты (а именно РНК), на данный момент однозначного ответа нет. Более подробно вы можете прочитать об этом в других замечательных книгах, например в книге Михаила Никитина «Происхождение жизни. От туманности до клетки». Самое главное, что к этому моменту уже существовали небольшие молекулы – аминокислоты.
Аминокислоты состоят из атомов углерода, водорода, азота и кислорода (в некоторых еще есть сера). Главная особенность этих молекул в том, что в их структуре есть две группы атомов, которые мы будем называть дальше функциональные группы, а именно, карбоксильная группа (—СООН группа) и аминогруппа (—NH2). Эти две группы охотно реагируют между собой, образуя особую химическую связь, так называемую пептидную. Полученную молекулу называют пептид, а точнее дипептид, поскольку она пока состоит из двух остатков аминокислот.
Та аминокислота, которая «отдала» в образование пептидной связи карбоксильную группу, будет называться N-концевая, поскольку у нее осталась непрореагировавшая аминогруппа.
Вторая аминокислота будет тогда С-концевой, поскольку у нее осталась свободная карбоксильная группа. Именно эта карбоксильная группа в природе дальше способна образовать еще одну пептидную связь с третьей аминокислотой. С-конец сместится на один остаток аминокислоты вперед. Так будут получаться трипептиды, тетрапептиды и т. д.
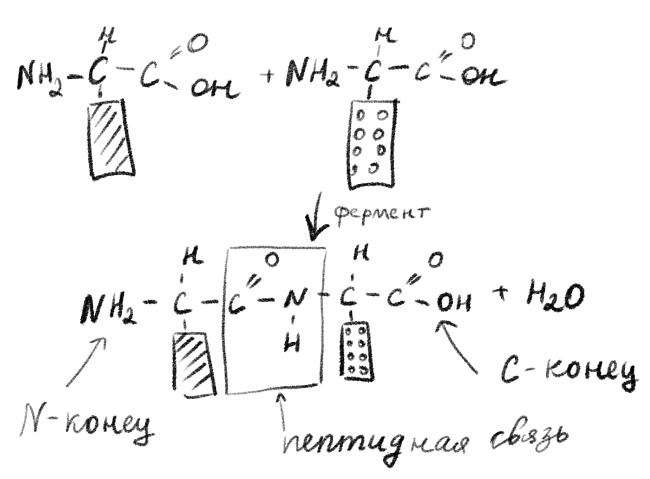
Рисунок 3. Из двух аминокислот получается дипептид
В лаборатории задача пептидного синтеза очень трудоемкая и требует долгих часов искусной работы химика-органика. Сейчас существуют автоматизированные системы синтеза пептидов, но все равно это задача, которую «на коленке» решить не удастся. Парадоксально, что даже в тот момент, когда химик в поте лица синтезирует какой-нибудь скромный трипептид, в его клетках легко и непринужденно с биологических конвейеров по производству белков – рибосом – сходят все новые и новые полипептиды, состоящие из 100, 200 и даже 500 остатков аминокислот.
Эти полипептиды похожи на огромные товарные поезда, в которых вагонов (то есть аминокислотных остатков) так много, что кажется будто эта вереница не закончится никогда.
Самый длинный полипептид в организме человека – титин, который состоит из почти 40 тысяч «вагонов» (если быть точным, то 38 138) и включает в себя более 422 тысяч атомов. Его биологическая роль заключается в сокращении поперечнополосатых мышц (например, камбаловидной мышцы в икрах). Так что, когда в следующий раз будете недовольны формой своей мускулатуры, задумайтесь, что за каждое движение ваших ног отвечают белки-рекордсмены.
Иногда два полипетида объединяются в одну молекулу с помощью других видов химической связи. Так, например, образуется молекула инсулина, пожалуй, одного из самых знаменитых представителей класса пептидов. Он состоит из 2 небольших пепетидных цепей в 21 и 30 аминокислотных остатков, которые соединяются с помощью связи между атомами серы (дисульфидные связи).
Для большинства белков помимо самого синтеза первичной пептидной цепи очень важно эту цепь правильно уложить в пространстве. Неупорядоченная цепь собирается в так называемый статистический клубок, и редко когда от такого клубка можно добиться толку. Для реализации биологических функций белок должен принять правильную «конформацию», словом, из клубка надо связать свитер.
Аминокислотная последовательность называется первичной структурой, но кроме нее существуют еще вторичная, третичная и даже четвертичная структуры.
Вторичная структура позволяет из полипептидной цепи собрать «листы» (их называют бета-листы или бета-слои) или спираль (альфа-спираль).
Третичная структура подразумевает организацию элементов вторичной структуры в «шарики»-глобулы. Иногда отдельные глобулы собираются в так называемые олигомерные белки – так получается четвертичная структура.
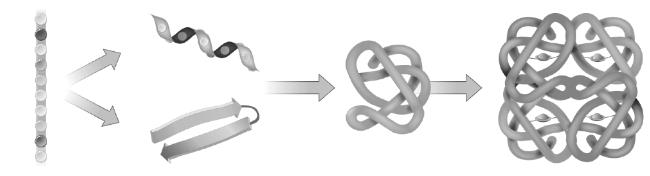
Рисунок 4. Примеры первичной, вторичной, третичной и четвертичной структур
Структура белка играет очень важную роль в выполнении им своей функции. Одна из любимых концепций в химии белка называется «связь структура – функция», которая отражает возможности предсказать функции белка по его структуре и управлять функциями белка, изменяя структуру.
А функций у белков множество. Принято выделять несколько групп (как минимум 8), объединяющих белки со схожими функциями.
Структурные белки, например, призваны обеспечить прочность и форму клеток, тканей и органов. Вы, наверное, помните о коллагене – важном белке наших кожи, хрящей, сухожилий. А волосы? Волосы – это, конечно, кератин, структурный белок с замечательными механическими свойствами. Благодаря массовой культуре и бьюти-индустрии коллаген и кератин являются, пожалуй, самыми медийными белками и ассоциируются с молодостью и красотой. И в этом есть большая доля правды!
Есть и другой класс белков, репутацию которым в массовом сознании сделала реклама. Это ферменты, и в первую очередь пищеварительные. Но поверьте, одними лишь ими многообразие ферментов не ограничивается!
Строго говоря, ферменты – белки, которые катализируют химические реакции в организме, ускоряя их скорость и обеспечивая эффективность всех биологических процессов. О них мы поговорим очень подробно в этой книге (см. следующую главу).
Отдельно рассматривают как вещества белковой природы некоторые гормоны. Например, очень известный гормон инсулин имеет пептидную природу. Они выступают в качестве регуляторов основных процессов, таких как обмен веществ, рост, развитие и другие.
Транспортные белки переносят различные вещества, такие как кислород и питательные вещества, по всему организму. Основной белок плазмы крови человека – альбумин, его называют «молекула-такси», потому что он помогает переносить самые разнообразные вещества по кровотоку.
А какие еще примеры? Рассмотрим транспорт железа в организме. Что сразу приходит на ум? Конечно, гемоглобин! Но при этом «рука об руку» с ним идет ферритин – белок, который выполняет запасающую функцию. Он работает «депо» железа в организме.
Защитные белки представляют собой антитела, которые борются с инфекциями и болезнями. Это наша иммунная память о встречах с различными патогенами. Пандемия COVID‑19 научила практически всех следить за уровнем пресловутых IgG и IgM, которые отражают наличие или отсутствие иммунитета к этой инфекции.
Мы уже упомянули белок титин, который выполняет двигательную функцию, ему в помощь приходят актин и миозин, участвующие в сокращении мышц, – моторные белки. Многие белки выполняют сигнальную роль, помогая клеткам обмениваться информацией и командами. Кроме этого, существуют еще и регуляторные белки, и ряд других более мелких подклассов.
В заключение отметим, что белки являются важнейшими молекулами в организме человека, участвующими в различных функциях и процессах. На планете Земля жизнь и правда – форма существования белковых тел. Разнообразие белков обеспечивает адаптивность организма, поддерживая здоровье и нормальное функционирование всех систем.
А пока пришел черед знакомится с самым сладким (а может и нет…) классом биомолекул – углеводами!


