
Дженнифер Даудна
Трещина в мироздании
Вирусы способны не только переносить свою ДНК внутрь клетки, но и обеспечивать ее сохранение там. В 1920–1930-е годы, на заре генетических экспериментов на бактериях, ученые недоумевали по поводу способности бактериальных вирусов возникать словно из ниоткуда и вызывать инфекции. Дальнейшие исследования показали, что эти вирусы могут вносить свой геном в бактериальную хромосому и таиться там до тех пор, пока условия не станут подходящими для интенсивного инфицирования. Ретровирусы – большой класс вирусов, к которым относится, например, вирус иммунодефицита человека (ВИЧ), – проделывают то же самое в организме человека, внося свой генетический материал в геном инфицированных клеток. Из-за этого вредоносного свойства уничтожить ретровирусы чрезвычайно сложно, и они сумели оставить огромный след в наследственности нашего вида. Целых 8 % генома человека – около 250 миллионов “букв” ДНК – это наследие древних ретровирусов, которые поражали наших предков много тысячелетий назад.
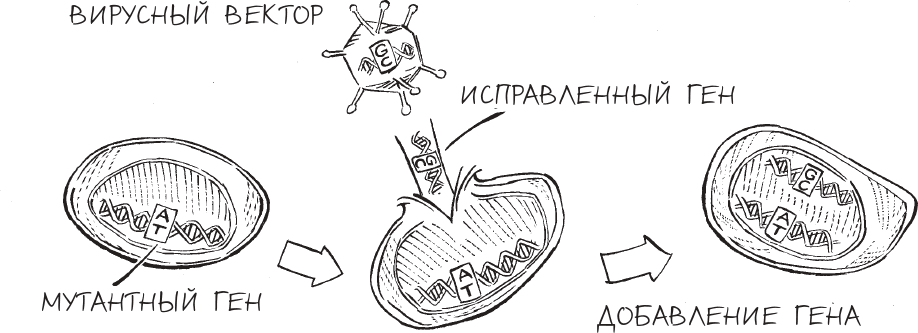
Генная терапия с использованием вирусных векторов
За первыми попытками генной терапии в 1960-х последовало быстрое развитие этой научной области, которое происходило благодаря революционной разработке, известной как рекомбинантная ДНК, – это собирательный термин для генетического кода, искусственно созданного в лаборатории. Используя новые биотехнологические инструменты и новые биохимические методы, ученые в 1970-х и 1980-х годах научились вырезать и вставлять фрагменты ДНК в геномы и выделять заданные последовательности генов. Это позволило им вставлять “лечебные” гены в вирусы и удалять опасные гены таким образом, что вирусы больше не вредили инфицированным клеткам. Ученые фактически превратили эти вирусы в нечто вроде тихих снарядов, предназначенных для того, чтобы доставить свой генетический заряд точно в нужную цель – и никуда более.
К концу 1980-х были проведены эксперименты на мышах, и в ходе этих экспериментов перенастроенные ретровирусы успешно вставляли произведенные в лаборатории гены в ДНК животных; теперь предстояло испытать генную терапию в клинических условиях. В это время я работала в Гарварде, проводила там исследования для своей докторской диссертации по биохимии; я помню, как мы с коллегами по лаборатории обсуждали новость о том, что Френч Андерсон и его коллеги из Национальных институтов здравоохранения первыми смогли провести клинические испытания. Они разработали многообещающий вектор, снабженный здоровой копией гена ADA (аденозиндезаминазы). Из-за мутации этого гена возникает недостаточность аденозиндезаминазы – формы ТКИД (тяжелого комбинированного иммунодефицита). Команда Андерсона хотела использовать генную терапию для того, чтобы навсегда включить здоровый ген ADA в состав кровяных телец пациентов, страдающих от ТКИД, – таким образом, чтобы эти клетки смогли вырабатывать недостающий белок. Андерсон и его коллеги надеялись, что это приведет к излечению от болезни.
К сожалению, результаты этого первого клинического испытания оказались не вполне ясными; перестроенный вирус вроде бы не причинил вреда ни одному из двух пациентов, которые его получили, однако и эффективность метода было трудно определить. К примеру, после проведения этой процедуры у обоих пациентов увеличилось количество жизнеспособных иммунных клеток – однако это улучшение могло быть вызвано и другими средствами, которые больные принимали параллельно с проведением генной терапии. Более того, в реальности лишь очень небольшое число клеток получило здоровый ген ADA, а это означало, что вирус, вероятно, не настолько эффективен в качестве средства доставки генов, как надеялись ученые.
Однако за три десятилетия, прошедших со времени этого первого и не слишком убедительного опыта, в области генной терапии происходил феноменальный прогресс. Усовершенствования в конструировании вирусных векторов и методов их доставки в клетки привело к чрезвычайно воодушевляющим результатам генной терапии ADA у десятков больных ТКИД, и коммерческий препарат под названием стримвелис, скорее всего, скоро будет одобрен экспертами[23].
По состоянию на 2016 год было проведено около 2000 испытаний различных видов генной терапии, и список недугов, поддающихся лечению этим методом, значительно расширился: теперь он включает такие моногенные наследственные заболевания, как муковисцидоз, миодистрофия Дюшенна, гемофилия, некоторые виды слепоты, а также все большее число различных сердечно-сосудистых и неврологических недугов. А перспективный метод иммунотерапии рака – при котором клетки, сражающиеся с опухолью, “заряжаются” генами, нацеленными на специфичные для опухолей молекулы, – был назван одним из самых многообещающих прорывов в онкологии и подтверждением того, что генная терапия еще много чего может предложить медицине.
Но, несмотря на шумиху, генная терапия пока не стала панацеей, как надеялись ученые и медики; напротив, в некоторых случаях она, кажется, принесла больше вреда, чем пользы. Тяжелый удар по этой области нанес 1999 год, когда один пациент умер после мощного иммунного ответа его организма на большую дозу вирусного вектора. В то время я преподавала в Йельском университете и была полностью погружена в исследования способа, которым вирусные молекулы РНК “взламывают” белоксинтезирующие системы в клетках. Хотя область моих исследований не слишком пересекалась с генной терапией, новости об этом катастрофическом исходе расстроили меня и одновременно заставили более целеустремленно работать над тем, чтобы лучше понимать устройство вирусов и клеток.
Позже, уже в начале 2000-х, у пяти пациентов, которым проводили генную терапию сцепленного с X-хромосомой ТКИД, развилась лейкемия – рак красного костного мозга. Это произошло из-за того, что ретровирус ошибочно активировал некий онкоген (один из генов, вызывающих рак), и это привело к неконтролируемому размножению клеток. Этот инцидент подчеркнул неотъемлемый риск, присущий методу, при котором пациентам вводятся большие количества чужеродного агента, а в их геномы случайно встраиваются несколько тысяч “букв” ДНК. Я помню, как тогда подумала, что эта область клинических исследований, в принципе столь многообещающая, может оказаться неприемлемо рискованной.
Кроме того, генная терапия по своей сути неэффективна для широкого ряда генетических заболеваний, которые не вызваны отсутствием или мутацией генов. Такие заболевания не могут быть исправлены простым добавлением новых генов в клетки. Возьмем, к примеру, хорею Гентингтона, при которой измененный ген вырабатывает белок аномального строения и действие этого гена полностью нивелирует действие другого, здорового. Так как мутантный ген доминирует над нормальным, простая генная терапия – то есть добавление еще одной нормальной копии гена с помощью специально видоизмененного вируса – никак не поможет в случае хореи Гентингтона или других заболеваний, наследуемых по доминантному типу.
В таких (и подобных) случаях врачам придется найти способ “починить” проблемные гены, а не просто заменить их. И если бы они научились восстанавливать дефектный код, вызывающий расстройства, то научились бы лечить как рецессивные, так и доминантные наследственные заболевания, не боясь при этом добавить ген не туда, куда следует.
Эта возможность интриговала меня с самого начала карьеры. В начале 1990-х, уже получив степень доктора философии[24] в Гарвардском университете, я в течение многих вечеров обсуждала эту идею с коллегами по лаборатории в Колорадском университете в Боулдере, где я была постдоком[25]. В те дни мы с моим другом и коллегой Брюсом Салленджером спорили обо всем подряд – от президентских выборов 1992 года (мне нравился Пол Цонгас, а Брюсу – Билл Клинтон) до различных стратегий генной терапии. Один из вопросов, который мы обсуждали, был таким: возможно ли отредактировать молекулы РНК – то самое связующее звено между ДНК и белком в клетке – таким образом, чтобы исправить мутации, которые эти молекулы “наследовали” от ДНК? Помимо всего прочего, это была тема исследовательского проекта Брюса. Иногда мы также обсуждали другую возможность: редактирование “исходного кода” таких дефектных РНК – то есть самой ДНК генома. Мы оба считали, что этот метод изменил бы все. Вопрос состоял лишь в том, удастся ли когда-нибудь воплотить эту идею в действительность.
На протяжении 1980-х, в то время как некоторые исследователи оттачивали методы переноса генов с использованием вирусов, другие искали более простые пути трансформации клеток млекопитающих, используя ДНК, изготовленную в лаборатории. Эти базовые методы предназначались прежде всего для фундаментальной науки, но со временем ученые начали также исследовать их потенциал для лечения клеток человека.
У этих подходов было несколько ключевых преимуществ перед более сложными техниками переноса генов. Прежде всего они были гораздо более быстрыми; вместо того чтобы “упаковывать” гены в перенастроенные вирусы, ученые могли вводить созданную в лаборатории ДНК напрямую в клетки или делать так, чтобы клетки сами поглотили ее: для этого последние погружались в специально приготовленную смесь ДНК и фосфата кальция. Во-вторых, хотя в этих более простых методах и не применялось встраивание новых генов в геномы клеток при помощи вируса, клетки могли объединять чужеродную ДНК со своей собственной – пусть и не слишком эффективно.
Мыши часто становились первыми подопытными животными, на которых тестировались эти техники, и ученые поражались тому, насколько эффективными оказывались такие методы применительно к маленьким созданиям. Вводя новую ДНК в оплодотворенные яйцеклетки мышей и затем имплантируя эти яйцеклетки в женские особи, исследователи обнаружили, что они могли перманентно встроить чужеродную ДНК в геномы представителей следующего поколения и вызвать наблюдаемые изменения в развивающихся животных. Эти достижения означали, что любой ген, который ученые были способны изолировать и клонировать в лаборатории, можно было попробовать ввести в клетку и изучить его поведение там; добавляя этот ген в клетки, ученые могли наблюдать его воздействие на организм и лучше понять его функции. Хотя моя научная работа в то время была в основном посвящена формам и функциям молекул РНК, я осознавала, что потенциальные последствия этих открытий были огромны.
Вопрос состоял в следующем: каким именно образом ДНК находит путь к геному? Марио Капекки, профессор университета Юты, пытался ответить на этот вопрос в начале 1980-х, сделав одно необъяснимое наблюдение: когда в один геном “подселяли” сразу много копий какого-нибудь гена, эти копии интегрировались в геном вовсе не беспорядочно, как этого можно было бы ожидать, а прямо наоборот. Капекки обнаружил, что копии гена, вместо того чтобы распределяться хаотическим образом по разным хромосомам генома, всегда собирались вместе в одной или немногих областях, при этом многие копии накладывались друг на друга, как будто их так собрали таким образом умышленно. Впоследствии ученый установил, что именно так оно и было[26].
Капекки наблюдал результаты процесса, называемого гомологичной рекомбинацией, – в тот момент это был уже хорошо известный феномен, однако ученый не ожидал наткнуться на него в этом эксперименте. Наиболее известный пример гомологичной рекомбинации – происходящая во время формирования яйцеклеток и сперматозоидов редукция каждого двойного набора хромосом (половину которого мы получили от матери, а половину от отца) до одинарного, который затем объединится со вторым таким же набором (у другого партнера) в ходе полового размножения[27]. В этом процессе избавления от “лишнего” клетки выбирают смесь отцовских и материнских хромосом; каждая пара хромосом вступает в своего рода половой акт, обмениваясь крупными фрагментами ДНК таким образом, что генетическое разнообразие в пределах одной хромосомы увеличивается. Несмотря на головоломную сложность смешивания, сопоставления и пересборки цепей из миллионов “букв” ДНК, клетки могут выполнять эти задачи безупречно именно благодаря процессу гомологичной рекомбинации. Тот же процесс происходит во всех царствах живых существ: к примеру, бактерии с его помощью обмениваются генетической информацией, а биологи пользуются преимуществами гомологичной рекомбинации для проведения генетических экспериментов на дрожжах в течение многих лет.
Тем не менее открытие того факта, что клеткам лабораторных млекопитающих также свойственно явление гомологичной рекомбинации, имело огромное значение. Марио Капекки писал в конце своей статьи 1982 года:
Будет интересно определить, сможем ли мы использовать [вовлеченные в процесс ферменты], чтобы путем гомологичной рекомбинации направленно воздействовать на гены, расположенные в определенных участках хромосом[28].
Другими словами, гомологичная рекомбинация позволяет ученым с безупречной точностью вставлять гены в подходящие места генома – а это поразительное усовершенствование по сравнению со случайной вставкой генов с помощью вирусов. И, что еще важнее, гомологичная рекомбинация может дать ученым возможность “переписывать” дефектные гены, помещая здоровые гены прямо в то место, где произошла мутация.
Спустя всего три года после экспериментов Капекки эта возможность воплотилась в реальность в примечательной научной работе, статью о которой опубликовал Оливер Смитис с коллегами. Работая с человеческими клетками, взятыми из опухолей мочевого пузыря, ученые поставили перед собой задачу заменить “доморощенные” копии гена бета-глобина в клетках на искусственные рекомбинантные версии, сконструированные в лаборатории. Невероятно, но это сработало[29]. Ученым не пришлось использовать никаких необычных трюков – они просто смешали ДНК с фосфатом кальция и опрыскали клетки полученной смесью – некоторые из клеток поглотили чужеродную ДНК, создали пары из разработанных в лаборатории цепочек ДНК и собственных подходящих последовательностей в геноме, а затем посредством некоторой “молекулярной гимнастики” заменили старые на новые.
Казалось, клетки могут проделывать большую часть сложной работы по модификации собственных геномов без посторонней помощи. Это означало, что ученые могли доставлять гены более мягким способом, не используя вирусы для “запихивания” новой ДНК в геном. Заставляя клетки “думать”, что рекомбинантная ДНК была лишь дополнительной хромосомой, которой нужно найти пару с подходящим геном, уже имеющимся в геноме, ученые могли гарантировать, что новая ДНК соединялась с изначально находящейся в клетке посредством гомологичной рекомбинации.
Ученые назвали этот новый подход к манипуляции с генами направленным воздействием на гены. Сегодня этот метод известен под другим именем: редактирование генома.
Потенциал этой технологии для генетических исследований был невероятно заманчив. Однако Смитис знал, что гомологичная рекомбинация может быть также использована и в качестве терапии. Если бы ученые смогли провести аналогичное направленное воздействие на гены в стволовых клетках пациентов, страдающих от серповидноклеточной анемии, то мутировавший ген бета-глобина можно было бы заменить на нормальную, здоровую последовательность. Открытие Смитиса было сделано в рамках экспериментального подхода, однако в один прекрасный день оно потенциально могло быть использовано для лечения заболеваний.
Другие лаборатории также вступили в конкуренцию за усовершенствование этой техники направленного воздействия на гены. Одной из них была лаборатория Капекки. В 1986-м, когда я была на втором курсе магистратуры, он показал, что гомологичная рекомбинация достаточно точна для того, чтобы исправлять даже точечные мутации в геноме и корректировать недостаточность ферментов в клетках[30]. Два года спустя Капекки предложил общую стратегию направленного воздействия на любой ген с известной последовательностью нуклеотидов в любом геноме. Он также предположил, что гомологичную рекомбинацию можно использовать не только для исправления и “ремонта” генов, но и для их инактивации в исследовательских целях[31]; “выключая” гены и наблюдая, что получится в результате, ученые могли определять функции этих генов.

Редактирование генома посредством гомологичной рекомбинации
К тому времени как я завершила работу над своей диссертацией на соискание степени доктора философии в конце 1980-х, направленное воздействие на гены широко применялось для редактирования ДНК в культурах клеток мышей и человека и даже в живых мышах. Важная работа, проведенная в лаборатории Мартина Эванса, продемонстрировала, что, направленно воздействуя на гены в эмбриональных стволовых клетках мышей и затем вводя эти измененные стволовые клетки обратно в мышиные эмбрионы, ученые могут создавать живых мышей с “дизайнерскими” изменениями. Важнейшие открытия, совершенные Капекки, Смитисом и Эвансом, впоследствии, в 2007 году, были удостоены Нобелевской премии по физиологии или медицине.
Впрочем, несмотря на свой колоссальный потенциал, редактирование генома поначалу больше подходило для фундаментальных исследований, чем для применения в лечении заболеваний у человека. Для ученых, исследующих генетику млекопитающих и пытающихся найти способы, которыми можно было бы выявить функции различных генов, метод направленного воздействия на гены в корне менял все. Однако исследователи-медики с настороженностью относились к использованию этого метода на людях, поскольку, несмотря на весь свой потенциал, гомологичная рекомбинация совсем не оправдывала ожиданий в том, что касалось лечения.
Возможно, самым важным сдерживающим фактором была проблема негомологичной (или незаконной) рекомбинации, при которой новая ДНК интегрируется в геном случайным образом, вместо того чтобы оказаться точно у подходящей последовательности. Фактически незаконная рекомбинация, похоже, происходила почти в сто раз чаще гомологичной, и, естественно, терапевтические перспективы технологии, которая могла исправить мутировавший ген лишь в 1 % измененных клеток, а в геном остальных 99 % “вклеивала” ДНК как попало, не выглядели слишком многообещающими. Ученые разрабатывали различные изящные пути обхода этой проблемы в клеточных культурах и не теряли надежду на то, что в будущем метод удастся применить в медицине. Как заявил Капекки в начале 1990-х, “в конце концов, гомологичная рекомбинация – единственный потенциально возможный метод генной терапии человека”[32]. Однако в то время казалось, что редактирование генома – просто недостаточно совершенная технология для того, чтобы применять ее на людях.
В начале 1980-х, пока другие ученые были поглощены мыслями о направленном воздействии на гены в клетках человека, Джек Шостак пытался разобраться в процессе клеточного деления у дрожжей. Шостак был профессором Гарвардской медицинской школы (и затем моим научным руководителем в работе над докторской диссертацией), и его занимал фундаментальный вопрос: как вообще возможны направленное воздействие на гены и гомологичная рекомбинация? В частности, Шостак хотел понять, каким образом две цепочки ДНК из одной хромосомы могут объединяться с двумя соответствующими цепочками ДНК из второй хромосомы, обмениваться информацией, слившись на время некой промежуточной стадии, и затем разделяться вновь, заново образуя отдельные хромосомы после деления клетки.
В 1983 году, когда я все еще была студенткой Помона-колледжа в Калифорнии, Шостак на другом конце страны решил, что нашел ответ. Основываясь на результатах экспериментов по генетике дрожжей, он и его магистрантка Терри Орр-Вивер вместе с профессорами Родни Ротштайном и Фрэнком Сталем обнародовали смелую модель[33], согласно которой провоцирующим фактором – сигналом, запускающим процесс гомологичной рекомбинации, – было разрезание одной из двух хромосом, что приводило к двуцепочечному разрыву ДНК. Согласно этой модели, двуцепочечный разрыв и освободившиеся концы ДНК на месте разрыва были особенно подвержены слиянию, а располагающиеся по бокам их последовательности с гораздо большей вероятностью могли быть вовлечены в обмен генетической информацией с соответствующей хромосомой (или, в случае редактирования генома, – с соответствующей ДНК, которую предоставлял исследователь).
К тому времени как я пришла в лабораторию Шостака в 1986 году, он уже сменил центральную повестку своих исследований на изучение роли молекул РНК на начальных этапах эволюции жизни на Земле. Однако в лаборатории мы с коллегами обсуждали модель двуцепочечных разрывов, ее изящество и тот неприкрытый скепсис, с которым она была встречена в научном сообществе. Но с течением времени становилось все яснее, что эта модель согласуется с большим количеством экспериментальных данных. Механизм репарации двуцепочечных разрывов казался логичным не только в случае процесса гомологичной рекомбинации при формировании яйцеклеток и сперматозоидов, но и при рекомбинации, происходящей каждый раз, когда была повреждена ДНК. Все клетки подвержены разрушительным для ДНК воздействиям, будь то рентгеновское излучение или канцерогены, и надо отметить, что клетки весьма эффективно справляются с репарацией таких разрывов, не теряя при этом генетической информации. Согласно модели Шостака, этот процесс репарации зависел от возможности хромосом обмениваться фрагментами посредством гомологичной рекомбинации, и именно поэтому наличие двух копий хромосом является выгодной эволюционной стратегией. Любое повреждение одной из хромосом можно репарировать, просто скопировав соответствующую последовательность со второй хромосомы.
Если модель двуцепочечных разрывов верна и выводы, полученные на дрожжах, справедливы и для млекопитающих, возникает очевидная возможность улучшить эффективность редактирования генома: сделать надрез в ДНК в точности в том месте, где необходимо провести редактирование. Если предстоит заменить дефектный ген в геноме на исправленную копию, созданную в лаборатории, то сначала нужно понять, как разрезать дефектный ген, вызвав локальный двуцепочечный разрыв в ДНК, – а затем добавить исправленную копию гена. Клетка, “почувствовав” разрыв, попыталась бы восстановить повреждение, начав поиск соответствующей хромосомы для копирования, – тут-то ученые и “подсунули” бы ей синтезированный ген. По сути дела, можно было заставить клетку “подумать”, что повреждение ее ДНК произошло по естественным причинам, и предоставить ей новый фрагмент ДНК под видом второй хромосомы, которую клетка могла бы использовать для репарации поврежденного участка.
В 1994 году исследователи из лаборатории Марии Джесин в Мемориальном онкологическом центре имени Слоуна – Кеттеринга (Нью-Йорк) стали первыми, кому удалось “обмануть” таким образом клетки млекопитающих, – об этом прорыве я читала с большим интересом, находясь неподалеку, в Нью-Хейвене, куда я только что приехала после завершения работы постдоком в Боулдере. Мне было чрезвычайно интересно узнать об этой важной работе, которая была основана на предложенной моим научным руководителем модели двуцепочечных разрывов и выполнена исследовательницей, которая, как и я, была увлечена молекулами жизни.
Эксперименты по редактированию генома, проведенные Джесин, были оригинальными и новаторскими. Ее стратегия заключалась в введении в мышиные клетки ферментов, разрезающих геном и создающих двуцепочечные разрывы; одновременно с этим она добавляла в клетки фрагменты синтезированной ДНК (шаблоны для репарации), соответствующие разрезанной последовательности ДНК. Затем исследовательница проверяла, получилось ли у мышиных клеток восстановить поврежденную ДНК с помощью вставки шаблона для репарации. Проводя этот же самый эксперимент с добавлением фермента и без него, Джесин смогла проверить свою гипотезу, что искусственно созданный двуцепочечный разрыв повышал эффективность гомологичной рекомбинации.
Сложность заключалась в том, чтобы подобрать подходящий фермент, разрезающий геном только в одном определенном месте из миллиардов возможных вариантов. Чтобы решить эту проблему, Джесин остроумно позаимствовала часть молекулярного механизма из дрожжей: эндонуклеазу I-SceI[34].
Нуклеазы – это ферменты, разрезающие нуклеиновые кислоты; одни режут РНК, другие – ДНК. Эндонуклеаза делает “надрез” где-то внутри цепочек, в отличие от экзонуклеаз, которые работают исключительно с концами цепочек. Некоторые эндонуклеазы чрезвычайно губительны для клеток, поскольку они “режут” практически любой фрагмент ДНК, который встречается им на пути, вне зависимости от последовательности нуклеотидов в нем. Другие эндонуклеазы действуют очень специфично и разрезают только строго определенные последовательности; а большинство ведет себя как нечто среднее между первыми и вторыми.
Эндонуклеаза I-SceI, которую выбрала Джесин, была одной из наиболее специфических эндонуклеаз, известных к тому времени: фрагмент ДНК должен был содержать определенную последовательность из восемнадцати нуклеотидов, чтобы фермент сделал в нем разрез. Использование высокоспецифичной эндонуклеазы было критически важно: если бы Джесин выбрала слишком “неразборчивый” фермент, он бы “порезал” геном как попало, и это не только сделало бы результаты более сложными для интерпретации, но и, вероятно, повредило бы клетку. Однако, обладая специфичностью к восемнадцатибуквенной последовательности ДНК, I-SceI разрезает только один фрагмент ДНК из более чем пятидесяти миллиардов возможных комбинаций. (По иронии судьбы, в мышином геноме нет подходящей последовательности из восемнадцати “букв”, поэтому, прежде чем приступить к своему эксперименту, Джесин пришлось добавить копию этой последовательности в ДНК мышей – чтобы ферменту было что резать.)
Результаты эксперимента Джесин[35] были потрясающими. Она добилась того, что точная репарация мутировавшего гена посредством гомологичной рекомбинации прошла в целых 10 % клеток; сейчас эта эффективность может показаться не слишком высокой, однако это было в сотни раз лучше, чем у лучших из достигнутых к тому времени результатов. На тот момент это было наиболее многообещающее свидетельство того, что гомологичная рекомбинация может рано или поздно позволить ученым переписывать генетический код без риска незаконной рекомбинации или риска случайного встраивания в геном различных последовательностей при использовании ретровирусных векторов. Стоит лишь инициировать двуцепочечный разрыв в нужном месте – и фактически все остальное клетки сделают сами.
Имелась только одна проблема: чтобы этот подход можно было практически использовать, нужно было научиться разрезать геном в строго заданных местах. В эксперименте Джесин для проверки правильности идеи последовательность, которую распознавала эндонуклеаза I-SceI, была искусственно добавлена в геном перед введением нуклеазы, однако последовательности многих болезнетворных генов, скажем так, незыблемы: их невозможно изменить таким образом, чтобы они “пришлись по вкусу” тому или иному придирчивому ферменту. После разрыва геном легко восстанавливался и включал в себя новую генетическую информацию – хитрость была в том, чтобы понять, как сделать разрыв в нужном месте.
Начиная с середины 1990-х, пока я разбиралась со структурами молекул РНК с их уникальным биохимическим поведением, другие ученые спешили разработать новые системы, которые, подобно I-SceI, могли бы направленно действовать на конкретные последовательности ДНК. Тот, кому удалось бы решить эту проблему, смог бы раскрыть весь потенциал редактирования генома.
К этим технологиям нового поколения предъявлялось три критически важных требования: они должны были распознавать определенную выбранную последовательность ДНК; уметь разрезать эту последовательность и легко подвергаться перепрограммированию, для того чтобы атаковать различные последовательности ДНК и инициировать их разрыв. Первые два условия были необходимы для создания двуцепочечных разрывов, а третье – для того, чтобы этот инструмент был максимально универсален. I-SceI превосходно отвечала двум первым критериям, однако совершенно не соответствовала третьему. Биоинженеры поняли: чтобы создать программируемую систему разрезания ДНК, нужно либо перестроить I-SceI таким образом, чтобы она могла атаковать разные последовательности, либо найти совершенно новую нуклеазу, которая уже “научилась” разрезать самые различные последовательности ДНК.
Попытки ученых видоизменить I-SceI не достигли цели (что и неудивительно, учитывая крайне сложное молекулярное устройство белков-ферментов), и вскоре стало ясно, что поиск других природных нуклеаз – гораздо более перспективный подход. Фактически, к тому моменту, когда Джесин вела свои эксперименты с I-SceI, ученые уже выделили десятки нуклеаз из целого ряда организмов и установили конкретные последовательности ДНК, служившие мишенями для этих ферментов. Однако существовала фундаментальная проблема: подавляющее большинство ферментов распознавали последовательности длиной лишь в 6 или 8 “букв” – то есть слишком короткие для того, чтобы с таким ферментом можно было работать. В геноме человека подобные последовательности встречаются десятки или даже сотни тысяч раз, и это означает, что, даже если нуклеаза способна стимулировать гомологичную рекомбинацию в одном гене, она в процессе может “порубить” почти весь геном. Клетка была бы разрушена еще до того, как у нее появится какой-либо шанс начать репарацию ДНК.
Исследователи не могли положиться ни на одну из ранее открытых нуклеаз, а поиск нового фермента, подобного I-SceI, для каждой новой попытки редактирования генома – задача совершенно неосуществимая. Если вы хотите превратить терапевтическое редактирование генома в эффективную технологию исправления болезнетворных мутаций, то медики не могут в каждом случае ждать, пока вы обнаружите нуклеазу, которая бы избирательно действовала именно на тот участок заданного гена, в котором у конкретного пациента вредоносная мутация. Вам необходима возможность “взять с полки” подходящую нуклеазу из уже открытых – или по крайней мере технология, позволяющая создавать нужные нуклеазы по мере необходимости.
Революционное исследование, предложившее решение этой проблемы, было проведено в 1996 году, хотя я тогда о нем не знала. Шринивасан Чандрасекаран, профессор из Университета Джонса Хопкинса, понял, что вместо создания нуклеаз “с нуля”, поиска новых в природе или переделывания I-SceI можно избрать смешанный подход: выбирать фрагменты существующих белков и комбинировать их. Такие химерные нуклеазы отвечали бы двум первым требованиям к редактирующей геном нуклеазе: они были бы способны распознавать определенную выбранную последовательность ДНК и делать в ней разрез.


